
進行胆道腺癌に対するgemcitabine+cisplatin(GP) 療法は、至適支持療法(BSC) と比較して生存期間を有意に延長させることが報告されている。また、S-1単剤療法、S-1+cisplatin(SP) 療法についても、進行胆道腺癌に対する抗腫瘍効果が認められている。
本試験では進行胆道腺癌の初回治療におけるGP療法とSP療法の有効性と安全性を検証する。
組織学的に証明された進行胆道腺癌の初回治療例をGP療法群、SP療法群に無作為に割り付けた、単施設無作為化第II相比較試験である。
層別化因子は肝内胆管癌/肝外胆管癌、遠隔転移あり/局所進行、測定可能病変の有/無で、一次エンドポイントは6ヵ月 progression free survival(PFS) 、二次エンドポイントはreponse rate(RR) およびoverall survival (OS) である。
| 投与方法 | |
| ・GP療法: | gemcitabine 1000mg/m2(fix dose rate; 10mg/m2/min) 、day1, 8 |
| cisplatin 60mg/m2 iv、day1、3週毎 | |
| ・SP療法: | S-1 40mg/m2、1日2回内服、day1-14 |
| cisplatin 60mg/m2 iv、day1、3週毎 | |
2008年3月~2009年3月の間にGP療法群に49例、SP療法群に47例が登録された。患者背景としては、GP群とSP群でそれぞれ、ECOG PS 2が14.2%と8.5%、局所進行例が28.6%と23.4%でGP療法群がやや多く、胆のう癌が26.5%と34%でSP療法群がやや多かった。観察期間中央値14.2ヵ月の時点で、一次エンドポイントの6ヵ月PFSはそれぞれ44%、35%とGP療法群で良好な傾向であった(図1) 。PFS中央値は5.7ヵ月と5.8ヵ月(HR=0.85、95%CI:0.52-1.36) 、1年OSは42%と22%で、OS中央値は10.1ヵ月と9.9ヵ月(HR=0.72、95%CI:0.45-1.17) (図2) 、RRは18.4%と21.3%であった。Grade 3/4の有害事象としては、好中球減少(49%、31.8%) 、血小板減少(22.4%、4.5%) 、発熱性好中球減少(4.1%、0%) がGP療法群で多く認められた。
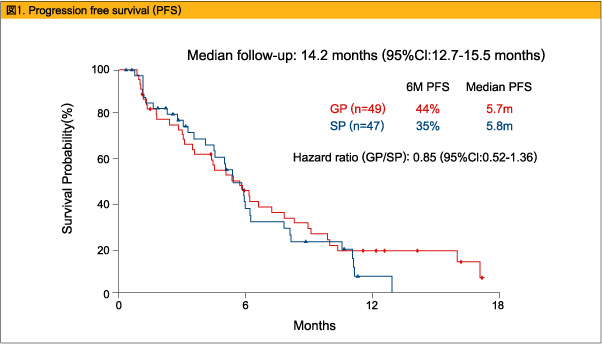
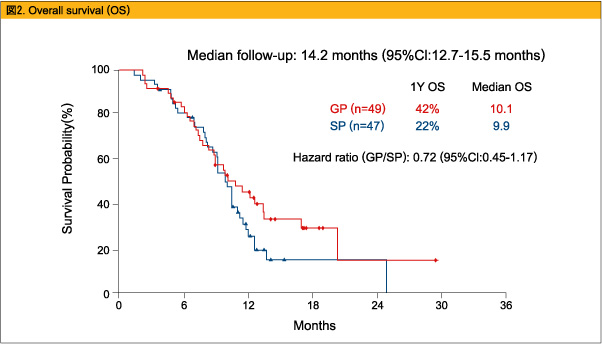
進行胆道腺癌に対するGP療法、SP療法はどちらも忍容可能であり、同程度の抗腫瘍効果を示した。GP療法はSP療法と比較し血液毒性の頻度が高く、また利便性に欠けるが、6ヵ月PFSおよび1年OSで良好な傾向を認めた。したがって、今後の進行胆道腺癌に対する化学療法としてはGP療法(fix dose rate) を選択して研究を進めていく。
進行胆道腺癌に対してGP療法とSP療法の有効性、安全性を検証する無作為化第II相試験である。以前に発表されたABC-02試験(N Engl J Med, 362(14) : 1273-81, 2010) ではMSTがGEM単独の8.2ヵ月に対して、GP療法では11.7ヵ月であり(HR=0.64、p<0.001) 、今回の試験でもGP療法とSP療法でほぼ同程度のMSTが得られていた。
一次エンドポイントである6ヵ月PFSでは確かにGP療法が上回っているものの、実際の生存曲線はほとんど重なっており、SP療法における経口薬としての利便性や血液毒性が軽度であることを考慮すると、より大規模な比較試験によってSP療法の有用性に関して評価すべきではないかと思われる。
(レポート:山崎 健太郎 監修・コメント:寺島 雅典)