
血管内皮細胞増殖因子 (VEGF) は多くの腫瘍で過剰発現しており、腫瘍の増殖や転移および予後に関連する。抗VEGF抗体であるbevacizumabは大腸癌をはじめ、多くの癌腫で有効性が証明され、進行胃癌に対しても第II相試験において有望な結果が報告されている。
本試験は多施設共同無作為化比較第III相試験である。
切除不能進行・再発胃癌・胃食道接合部癌(腺癌)の初回治療例を、capecitabine*+cisplatin+bevacizumab療法 (XP+Bev群)、capecitabine*+cisplatin+placebo療法 (XP+placebo群) に無作為に割り付けた。(*Capecitabineが使用できない地域では5-FUを使用した。)
| ・XP+Bev療法: | capecitabine (1000mg/m2、1日2回、day1-14) +cisplatin (80mg/m2、day1) +bevacizumab (7.5mg/kg、day1、3週毎) |
| ・層別化因子: | 地域 (アジア、欧州、汎アメリカ)、使用薬剤 (capecitabine/5-FU)、病状 (局所進行/遠隔転移あり)。 |
| ・一次エンドポイント: | overall survival (OS) 中央値10.0ヵ月→12.8ヵ月 (HR=0.78)、両側α=0.05、検出力80%、必要症例数760例)。 |
| ・二次エンドポイント: | progression-free survival (PFS)、time to progression (TTP)、objective response rate (ORR)など。 |
2007年9月~2008年12月の間に17ヵ国、93施設より774例が登録された (両群に各387例)。患者背景は両群で大きな差はなく、登録地域はアジア49%、欧州32%、汎アメリカ19%、capecitabineの使用率は94%であった。
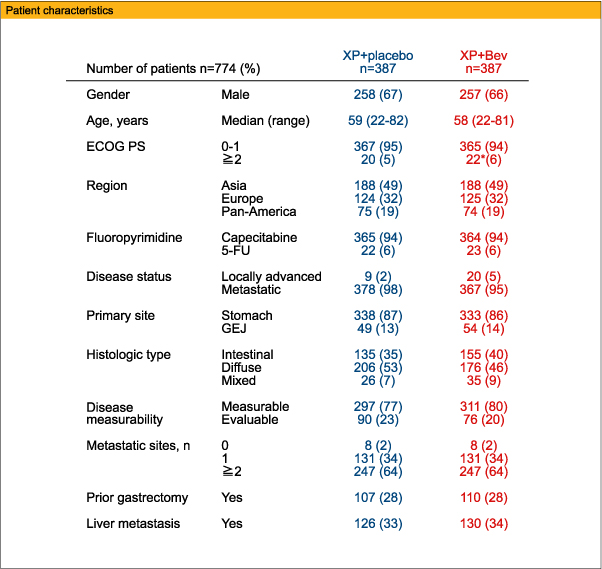
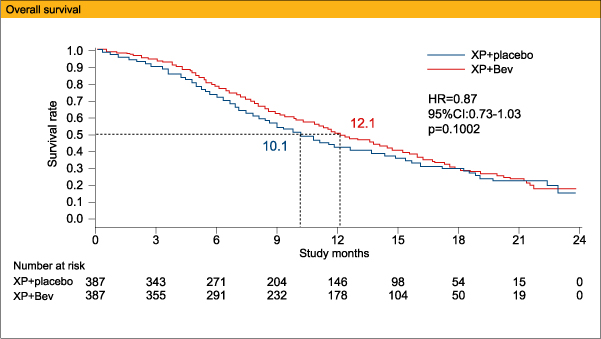
一次エンドポイントのOS中央値は、XP+Bev群12.1ヵ月、XP+placebo群10.1ヵ月 (HR=0.87、95%CI:0.73-1.03、p=0.1002)と有意差は認めなかったが、二次エンドポイントのPFS中央値は、それぞれ6.7ヵ月、5.3ヵ月 (HR=0.80、95%CI:0.68-0.93、p=0.0037)、ORRは46%、37% (p=0.0315)と、XP+Bev群で有意に良好であった。
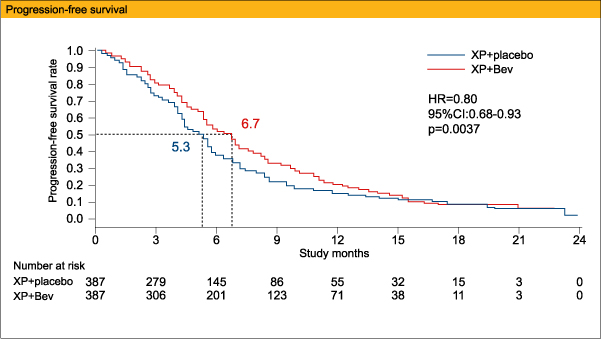
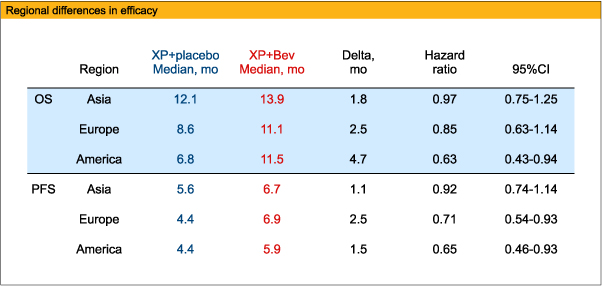
地域別のサブグループ解析では、OS中央値がXP+Bev群とXP+placebo群でそれぞれ、アジアで13.9ヵ月、12.1ヵ月 (HR=0.97、95%CI:0.75-1.25)、欧州で11.1ヵ月、8.6ヵ月 (HR=0.85、95%CI:0.63-1.14)、汎アメリカで11.5ヵ月、6.8ヵ月 (HR=0.63、95%CI:0.43-0.94)、PFS中央値がアジアで6.7ヵ月、5.6ヵ月 (HR=0.92、95%CI:0.74-1.14)、欧州で6.9ヵ月、4.4ヵ月 (HR=0.71、95%CI:0.54-0.93)、汎アメリカで5.9ヵ月、4.4ヵ月 (HR=0.65、95%CI:0.46-0.93)と、アジアよりも欧州、汎アメリカで両群間の差が顕著であった。
一次エンドポイントであるXP+Bev群のOSにおける優越性は示せなかった。一方、二次エンドポイントのPFS、ORRは有意に良好であった。結果は地域により異なっており、腫瘍部位やPS、臨床背景などが関連しているのかもしれない。現在、バイオマーカーを含めた解析が進行中である。
進行再発胃癌に対して、化学療法にbevacizumabの上乗せ効果を検証する無作為化比較臨床第III相試験である。我が国も参加していた国際共同試験で、極めて迅速に症例が集積された。胃癌に対するVEGFを標的とした初めての臨床試験として期待が大きかっただけに、ネガティブな結果で非常に残念である。
今回の結果から、二つの点が検討課題として挙げられると思われる。一つ目は、国際共同試験に関する問題である。会場でProf. Ajaniが自身のFLAGS試験の経験をふまえて同じ質問をしていた。症例集積の時間短縮や、各地域における承認申請のためには有利なのだろうが、患者背景や医療事情により地域差が予測される場合は、結果の解釈の点からも地域毎に試験を実施したほうがよいのではないだろうか。もう一つは進行再発胃癌の化学療法における有効性の評価方法である。一次治療の有効性を検証するための一次エンドポイントとしてはPFSのほうがより適切と思われる。もちろん、OSは最もsolidな基準ではあるが、我が国のように多くの症例で二次治療、三次治療が行われている場合、OSは必ずしも一次治療の効果を反映しているとは言い難いものと思われる。いずれにせよ今回の結果から、bevacizumabは進行再発胃癌に対する一次治療としては有効性が確認されなかった。今後は二次治療薬としての有効性の確認や、VEGFを標的とした他の薬剤による有効性を検討すべきであると思われた。
(レポート:山崎 健太郎 監修・コメント:寺島 雅典)