RAS ファミリーとシグナル伝達機構
癌遺伝子であるRAS には、KRAS 4A、KRAS 4B、NRAS 、HRAS という4つのファミリーがあります。大腸癌でみられる変異の大半がKRAS とNRAS に存在するため、我々は最初にKRAS exon 2の解析を行い、その後にKRAS exon 3, 4およびNRAS exon 2, 3, 4まで解析を進めました。
正常細胞のRAS に変異はなく、GDPと結合した不活性状態にあります。リン酸化によってGTPに変換されるとRAS が活性化され、シグナルが伝達されますが、ネガティブフィードバックによって不活性型に戻り、シグナル伝達が妨げられます (図1) 1)。一方、RAS のいずれかに変異があるとネガティブフィードバックが機能せず、増殖、腫瘍成長、細胞分化などの経路が永続的に活性化されてしまいます。抗EGFR抗体薬はRAS に変異のない野生型のみに作用し、シグナル伝達を阻害します。
KRAS exon 2野生型におけるPanitumumabの有効性
PRIME試験は、切除不能進行・再発大腸癌に対する1st-lineにおいて、FOLFOX4とFOLFOX4 + Panitumumabを比較した第III相試験です。当初は遺伝子変異によらず全症例が対象となっていましたが、後ろ向き解析のために、あらかじめ腫瘍組織を集積していました。また、その後にKRAS exon 2を対象とした前向き仮説が立てられましたが、検出力は十分でした。
これまでKRAS exon 2野生型を対象に3回のOS解析が行われています。初回解析 (54%のOSイベント) では、OS中央値はFOLFOX4群19.7ヵ月、FOLFOX4 + Panitumumab群23.9ヵ月と、Panitumumab併用により4.2ヵ月のOS延長効果がみられましたが、有意差は認められませんでした (HR=0.83, p=0.072) 2)。プロトコールに従って行われた最終解析 (68%のOSイベント) でも同様に有意差は認められませんでしたが (HR=0.88, p=0.17) (図2) 3)、2013年1月に米国FDAとEMAの要請を受けて行われたOS update解析 (82%のOSイベント) では、有意差が認められました (HR=0.83, p=0.03) (図3) 4)。つまり、長期追跡により十分なイベント数が蓄積されたことで、PFSのみならずOSでも有意差が示されたということです。PFSをOSのサロゲートエンドポイントとする場合は、長期追跡することが大事だと考えられます。
KRAS exon 2野生型患者におけるPRIME試験の最終結論としては、FOLFOX4にPanitumumabを併用することで、OSで有意に17%のリスク軽減がみられたということが言えます。
RAS 変異の有無におけるPanitumumabの有効性
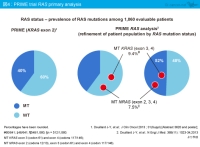

続いて、その他のRAS およびBRAF 変異の影響について検討しました5)。遺伝子変異の分布をみると、KRAS exon 2 (codon 12, 13) が40%、KRAS exon 3 (codon 61) が4%、exon 4 (codon 117, 146) が6%、NRAS exon 2 (codon 12, 13) が3%、exon 3 (codon 61) が4%、そしてBRAF exon 15 (codon 600) が8%認められました。つまり、全症例の60%であるKRAS exon 2野生型にもその他のRAS 変異が認められ、全ての変異を除いたRAS 野生型は全体の48%でした (図4)。なお、今回の解析では双方向性のサンガー法によるDNAシークエンシングならびにWAVE-based SURVEYOR Scan kitを用いましたが、NRAS exon 4 (codon 117, 146) には変異を認めませんでした。
RAS 変異の有無により解析を行ったところ、RAS 野生型におけるPFS中央値はFOLFOX4群7.9ヵ月、FOLFOX4 + Panitumumab群10.1ヵ月であり (HR=0.72, p=0.004)、KRAS exon 2野生型 (8.0 vs. 9.6ヵ月、HR=0.80, p=0.02) と比べてPanitumumab併用によるPFSの延長効果がより顕著になりました (図5)。したがって、RAS 変異は予後因子ではなく、Panitumumabの効果予測因子であることがわかります。
KRAS exon 2野生型でその他のRAS にいずれかの変異を有する患者におけるPFS中央値は、FOLFOX4群8.0ヵ月、FOLFOX4 + Panitumumab群7.3ヵ月であり (HR=1.28, p=0.33)、Panitumumabを併用することで不良な傾向がみられました。また、KRAS exon 2を含めたRAS にいずれかの変異を有する患者 (RAS 変異型) では、Panitumumab併用により有意に不良でした (HR=1.31, p=0.008)。
OSについても同様です。初回解析時点におけるRAS 野生型のOS中央値は、FOLFOX4群20.2ヵ月、FOLFOX4 + Panitumumab群26.0ヵ月 (HR=0.78, p=0.043) であり、KRAS exon 2野生型 (19.7 vs. 23.9ヵ月、HR=0.83, p=0.072) と比べて、Panitumumab併用により大きな改善がみられました (図6)。
KRAS exon 2野生型でその他のRAS 変異型においては、有意差は認めなかったもののPanitumumabを併用することで不良な傾向がみられ (18.3 vs. 17.1ヵ月、HR=1.29, p=0.31)、RAS 変異型では有意に不良でした (19.2 vs. 15.6ヵ月、HR=1.25, p=0.03)。
PRIME試験のRAS 解析の結果、RAS 野生型では、PFS、OSともにPanitumumab併用による有意な改善がみられ、OS中央値で5.8ヵ月の差を認めました。一方、RAS 変異型ではPFS、OSともにPanitumumab併用により有意に不良でした。つまりRAS はPanitumumabの強力な効果予測因子であり、投与対象の選択基準になります。これに対応して、EMA(欧州医薬品庁)では2013年6月27日にPanitumumabが、11月21日にはCetuximabもラベル変更され、抗EGFR抗体薬の対象はKRAS /NRAS exon 2, 3, 4に変異がないRAS 野生型となりました。
抗EGFR抗体薬治療後の2nd-lineにおける抗VEGF抗体薬
PRIME試験では、FOLFOX4群とFOLFOX4 + Panitumumab群ともに約1/3の患者が2nd-lineで抗VEGF抗体薬を投与しており、その大半はCPT-11ベースの化学療法と併用されていました6)。そこで、2nd-lineにおける抗VEGF抗体薬の投与の有無について検討したところ、RAS 野生型におけるOS中央値は、抗VEGF抗体薬投与例38.1ヵ月、非投与例23.6ヵ月であり (HR=0.63, p=0.0004)、抗VEGF抗体薬の投与によりOSの大幅な改善効果が認められました。この結果は、1st-lineでFOLFOX4 + Panitumumabによる治療を行った症例でより顕著であり、抗VEGF抗体薬投与例40.0ヵ月、非投与例26.0ヵ月とOSの延長効果が認められています (HR=0.64, p=0.0211) (表1)。E3200試験では、2nd-lineにおけるBevacizumabの高い有効性が認められています7)。そのことに加え、このデータは、1st-lineで抗EGFR抗体薬を使用すると、腫瘍の微小環境が変化して、抗VEGF抗体薬に対する感受性が高まるとの仮説を支持するものだと思います。
なお、2nd-lineでの抗VEGF抗体薬投与の有無で、1st-lineでのFOLFOX4群とFOLFOX4 + Panitumumab群の効果を比較したところ、抗VEGF抗体薬投与例 (HR=0.64, p=0.0494)、非投与例 (HR=0.69, p=0.0096) のいずれも、1st-lineにおけるPanitumumab併用によるOSベネフィットが2nd-line後も維持されていました。
RAS 野生型の1st-lineにおける最適な治療

次に、RAS 野生型における最適な治療戦略を考えてみたいと思います。
PEAK試験は、1st-lineにおいてmFOLFOX6 + BevacizumabとmFOLFOX6 + Panitumumabを比較した無作為化第II相試験です。2013年の米国臨床腫瘍学会年次集会でRAS 解析が報告され、KRAS exon 2以外のRAS 変異は22%と、PRIME試験と同程度でした。
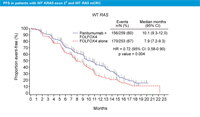
RAS 野生型におけるPFS中央値は、mFOLFOX6 + Bevacizumab群10.1ヵ月、mFOLFOX6 + Panitumumab群13.0ヵ月であり、mFOLFOX6 + Panitumumab群で有意な延長を認めました (HR=0.66, p=0.03)。mFOLFOX6 + Panitumumab群のPFS中央値はPRIME試験よりもさらに延長していますが、これは恐らくBevacizumab使用のために高血圧や血栓症、出血リスクのある患者が除外されるなど、患者選択がより厳格に行われたことが影響していると考えられます。
OSについても同様です。OS中央値は、mFOLFOX6 + Bevacizumab 群28.9ヵ月、mFOLFOX6 + Panitumumab群41.3ヵ月であり、大きな改善傾向がみられました (HR=0.63, p=0.058) (図7)。イベント数が少ないため有意差は認められませんでしたが、イベント数が増えればPRIME試験と同様に有意差がつく可能性があるでしょう。
PEAK試験におけるOSの差が大きいことから、RAS 野生型における最適な1st-line治療は、FOLFOX + Bevacizumabではなく、FOLFOX + Panitumumabである可能性が高いと考えられます。PRIME試験で示されたように、RAS 野生型に対する1st-lineでFOLFOX + Panitumumabを投与した後に、2nd-lineでFOLFIRI + Bevacizumabを投与すれば、OS中央値は40ヵ月に達します。これは非常に重要なことです。
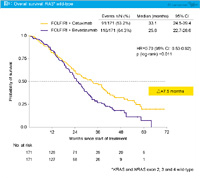
1st-lineにおいてFOLFIRI + BevacizumabとFOLFIRI + Cetuximabを比較したFIRE-3試験の結果も、同様の傾向を示しています。RAS 野生型におけるOS中央値は、FOLFIRI + Bevacizumab群25.6ヵ月、FOLFIRI + Cetuximab 群33.1ヵ月であり、FOLFIRI + Cetuximab群で有意な延長を認めました (HR=0.70, p=0.011) (図8)。2nd-lineで使用したレジメンについても、両群で非常にバランスがとれています。
ただ、FIRE-3試験では、OSで有意なベネフィットが得られているにもかかわらず、主要評価項目である奏効率やPFSで差が認められていないことが議論になっています。腫瘍のバイオロジーが変化する可能性も考えられますし、今後、多くのデータが示されるでしょう。
以上より、切除不能進行・再発大腸癌に対する治療においてRAS statusが非常に重要であることは明白であり、1st-lineを行う前にRAS 検査を行いRAS statusを確認すべきです。切除不能進行・再発大腸癌患者の約半数のRAS 野生型では、抗EGFR抗体薬による大きな治療ベネフィットが得られ、PanitumumabはPRIME試験、PEAK試験においてPFSおよびOSにおける治療ベネフィットが認められています。また、PEAK試験とFIRE-3試験の結果を見る限り、1st-lineで抗EGFR抗体薬を使用し、2nd-lineでBevacizumabを使用することがベストな治療順といえるでしょう。今年の米国臨床腫瘍学会年次集会で、1st-lineにおいてFOLFOX/FOLFIRI + BevacizumabとFOLFOX/FOLFIRI + Cetuximabを比較したCALGB80405試験の結果が報告される予定ですが、我々に何らかの答えを与えてくれることを期待します。