背景と目的
近年、RAS 遺伝子解析が切除不能進行・再発大腸癌への抗EGFR抗体薬の使用において重要であることが示されている1,2)。KRAS 野生型の切除不能進行・再発大腸癌に対する1st-line治療としてPanitumumab + mFOLFOX6とBevacizumab + mFOLFOX6を比較したPEAK試験では、Panitumumab群において良好なOS (中央値34.2ヵ月 vs. 24.3ヵ月, HR=0.62, 95% CI: 0.44-0.89, p=0.009) が認められ、RAS 野生型の症例においても同様の傾向 (41.3ヵ月 vs. 28.9ヵ月, HR= 0.63, 95% CI: 0.39-1.02, p=0.058) であった3)。一方、RECISTに基づいた奏効率ではPanitumumab群57.8%、Bevacizumab群53.5% (RAS 野生型: 63.6% vs. 60.5%)と両群に差を認めなかったが、近年では1st-line治療においてRECISTに基づいた奏効率ではなく早期腫瘍縮小 (early tumor shrinkage: ETS)、腫瘍縮小の深さ(depth of response: DpR)、効果持続期間 (duration of response: DoR) などの長期予後に影響を与える可能性が示唆されている2)。
本研究では、PEAK試験における両群の腫瘍縮小効果について解析された。
対象と方法
PEAK試験に登録された症例のうち、RAS 野生型症例において、奏効率 (担当医評価)、DoR中央値 (最初に効果を確認してから病勢進行もしくは死まで)、無作為化から奏効までの期間 (time to response : TTR)、DpR (最も腫瘍が縮小した時点、もしくは進行を認めた時点でのベースラインからの腫瘍縮小率)、ETS (治療開始8週時点での腫瘍縮小率が20%もしくは30%を超えた症例の割合)、CEAの推移が検討された。
結果
RAS 野生型の169例が解析され、そのうち154例でベースラインと8週時点の腫瘍縮小の評価が可能であった。
・奏効率はPanitumumab群64.8% (95% CI: 53.9-74.7)、Bevacizumab群61.7% (95% CI: 50.3-72.3)であった。
・TTR中央値はPanitumumab群2.3ヵ月 (95% CI: 1.9-3.7)、Bevacizumab群3.8ヵ月 (95% CI: 3.3-5.4) であった (HR=0.85, 95% CI: 0.58-1.25, p=0.4090)。
・DoR中央値はPanitumumab群11.4ヵ月 (95% CI: 9.7-13.6)、Bevacizumab群8.5ヵ月 (95% CI: 6.3-9.3) と、Panitumumab群においてより長い効果持続期間を認めた (p=0.0159)。
・DpR中央値はPanitumumab群65% (IQR: 48-87)、Bevacizumab群46% (IQR: 29-62) であり、Panitumumab群においてより深い腫瘍縮小を認めた (p=0.0007)。
・ベースラインからの腫瘍縮小はPanitumumab群において良好であった (図1)。
図1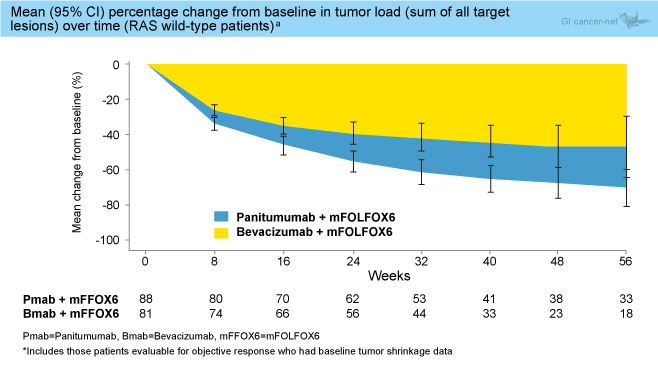
・CEAは多くの時点においてPanitumumab群がBevacizumab群より低値であった (図2)。75%以上のCEA低下を認めた症例はPanitumumab群55.6%、Bevacizumab群46.6%であった (OR=0.70, 95% CI: 0.35-1.38)。
図2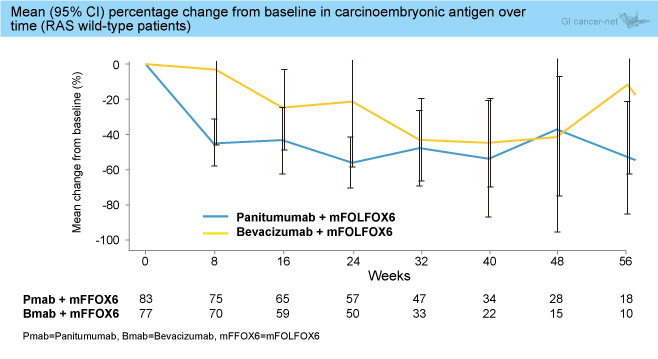
・8週時点で30%以上の腫瘍縮小が認められたETSの症例はPanitumumab群64%、Bevacizumab群45%であり、Panitumumab群で多かった (表1)。また、ETSを認めた症例では認めなかった症例と比較して、良好なPFSが得られた (ETS30%以上 12.8ヵ月 vs. ETS30%未満 9.7ヵ月, HR=0.54, 95% CI: 0.36-0.80, p=0.0019)。
表1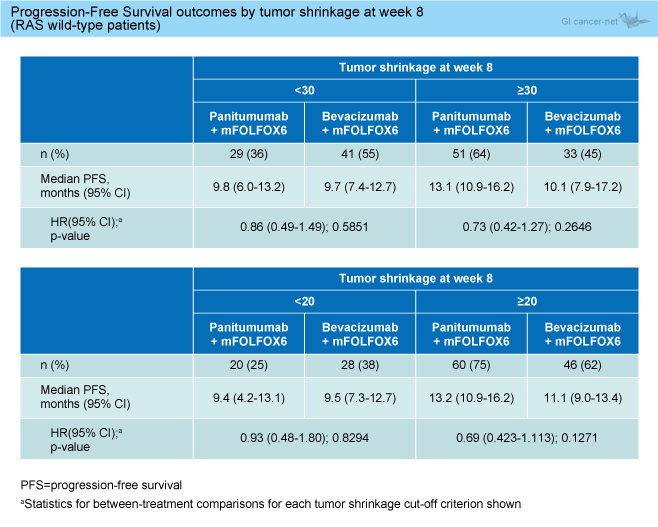
結論
PEAK試験においてPanitumumab群とBevacizumab群の奏効率に差はみられなかったが、Panitumumab群においてより早く、より深く、より持続期間の長い腫瘍縮小効果が認められた。このことはPanitumumab群においてOSやPFSが良好であったとの結果を支持するものと考えられる。
コメント
PEAK試験は無作為化第II相試験であるが4)、mFOLFOX6に対するPanitumumabとBevacizumabの併用効果を比較したhead-to-headの臨床試験であり、2013年米国臨床腫瘍学会年次集会で報告されたFIRE-3試験5)とともにその結果が注目された。
PEAK試験では、RAS 野生型症例において両群で奏効率に差を認めないものの、OSやPFSはPanitumumab群が良好であった。切除不能進行・再発大腸癌を対象とした従来の研究結果には、標準治療群と試験群の間にPFSの差を認めてもOSに差を認めないことが多かった。本試験では、この特徴的な結果に対し、TTRやDpRでその機序を説明することを企図した研究といえるであろう。
本試験の結果は、FIRE-3試験と同様に、ETSとDpRの違いが両群のPFSとOSの差をもたらしたことを示唆するものである。また、肝転移に対するconversion therapyにおけるPanitumumabのBevacizumabに対する優位性をうかがわせる結果ともいえる。
(レポート:中村 将人 監修・コメント大村 健二)
- Reference
- 1) Heinemann V, et al.: Lancet Oncol. 15(10): 1065-1075, 2014 [PubMed] [論文紹介]
- 2) Stintzing S, et al.: ESMO 2013: abst #LBA17 [学会レポート]
- 3) Schwartzberg LS, et al.: J Clin Oncol. 32(21): 2240-2247, 2014 [PubMed] [論文紹介]
- 4) Schwartzberg LS, et al.: 2013年消化器癌シンポジウム: abst #446 [学会レポート]
- 5) Heinemann V, et al.: 2013 Annual Meeting of the American Society of Clinical Oncology®: abst #3506 [学会レポート]

