背景と目的
KRAS 野生型切除不能進行・再発大腸癌の1st-lineとしての抗EGFR抗体併用療法と抗VEGF抗体併用療法の直接比較試験のうち、FOLFIRI療法をbackboneとした比較試験の結果は報告されていない。AIO KRK-0306 (FIRE-3) 試験は、切除不能進行・再発大腸癌の1st-lineにおけるFOLFIRI + Cetuximab療法とFOLFIRI + Bevacizumab療法の有効性を比較する第III相試験である。
対象と方法
対象は18歳以上、ECOG PS 0-2の未治療切除不能進行・再発大腸癌患者であり、FOLFIRI + Cetuximab療法とFOLFIRI + Bevacizumab療法に無作為に割り付けられた。
- Cetuximab群; FOLFIRI (Irinotecan 180mg/m2、Folic acid 400mg/m2、5-FU bolus 400mg/m2, day1、5-FU ci 2400mg/m2, day1-2, 2週毎) + Cetuximab (400mg/m2 day1, 以後 250mg/m2 毎週投与)
- Bevacizumab群; FOLFIRI + Bevacizumab (5mg/kg, 2週毎)
試験開始当初はKRAS 変異の有無にかかわらず登録可能であったが、2008年10月以降はKRAS 野生型に登録が限定された。登録症例のうち割り付けされた治療が1度でも投与されたすべてのKRAS 野生型症例を解析対象集団 (ITT集団) とした。主要評価項目をRECIST v1.0での担当医評価による奏効率 (ORR)、副次評価項目をPFS (progression-free survival)、OS (overall survival)、TTF (time to treatment failure:治療成功期間)、腫瘍縮小の程度 (deepness of response)、肝転移切除率、有害事象、忍容性とした。
Cetuximab群の期待奏効率を62%、Bevacizumab群を50%と想定し、検出力80%および片側α=0.025により、必要症例数を各群284例とした。
図1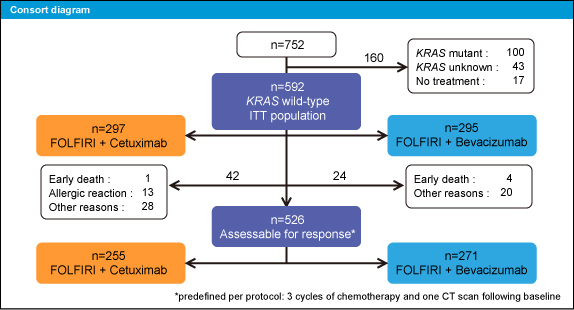
結果
全752例が無作為に割り付けられ、ITT集団はCetuximab群297例、Bevacizumab群295例であった。患者背景は両群間でよくバランスがとれていた。
表1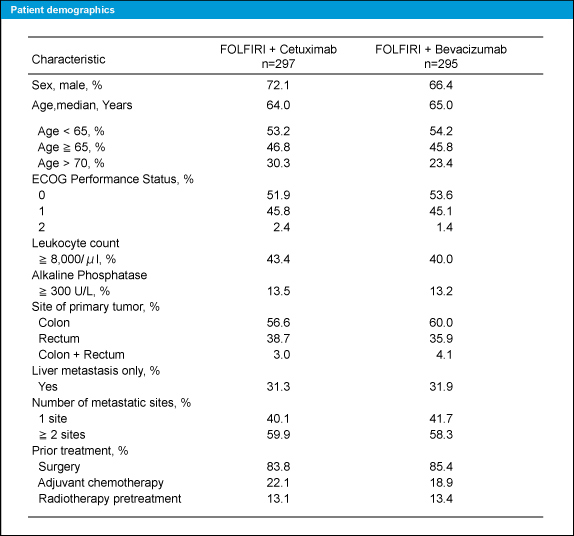
腫瘍縮小効果はCetuximab群でCR 4.4%、PR 57.6%、SD 17.5%、PD 7.1%、NE 13.1%であり、Bevacizumab群でCR 1.4%、PR 56.6%、SD 28.8%、PD 5.4%、NE 7.8%であった。結果、主要評価項目であるITT集団での奏効率はCetuximab群62.0%、Bevacizumab群58.0%であり、両群間に有意な差は認められなかった (odds ratio 1.18, 95% CI: 0.85-1.64, p=0.183)。ITT集団のうち奏効評価可能集団 (治療が3サイクル以上行われ、CT検査が少なくとも1回以上行われた症例と定義) に限定すると、Cetuximab群の奏効率が良好な傾向であった (72.2% vs. 63.1%, odds ratio=1.52, 95% CI: 1.05-2.19, p=0.017)。
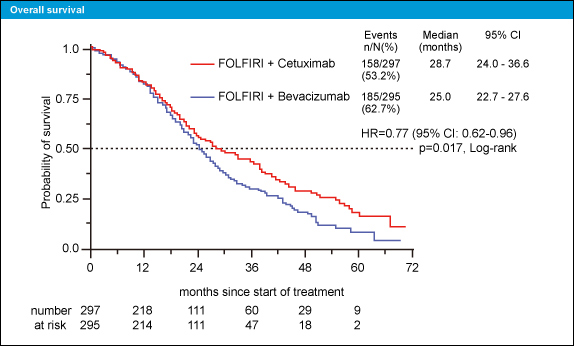
観察期間中央値Cetuximab群33.0ヵ月、Bevacizumab群39.0ヵ月時点でのPFS中央値はCetuximab群10.0ヵ月、Bevacizumab群10.3ヵ月であり両群に差を認めなかった (HR=1.06, 95% CI: 0.88-1.26, p=0.547)。一方、OSについてはCetuximab群がBevacizumab群よりも有意に良好であった(中央値28.7ヵ月 vs 25.0ヵ月, HR=0.77, 95% CI: 0.62-0.96, p=0.017)。
図2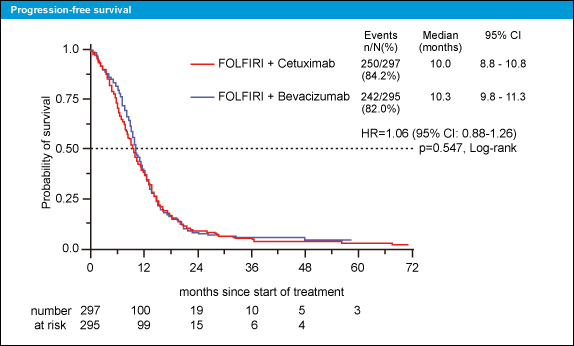
3剤すべての治療を施行できた期間 (中央値) はCetuximab群4.8ヵ月、Bevacizumab群5.3ヵ月と両群に差を認めなかったが (p=0.112)、施行サイクル数中央値はCetuximab群10回、Bevacizumab群12回と有意差を認めた (p=0.014)。
Grade 3以上の有害事象は、血液毒性については両群で差がなく、非血液毒性では手足症候群、ざ瘡様皮疹、低マグネシウム血症などがCetuximab群で有意に多く認められたが、予想される範囲内であった。
後治療移行割合はCetuximab群65.7%、Bevacizumab群61.7%で有意差がなく (p=0.347)、2nd-line治療でのBevacizumab併用割合はCetuximab群48.2%、Bevacizumab群17.8%であり、抗EGFR抗体併用割合はCetuximab群14.4%、Bevacizumab群42.9%であった。
結論
切除不能進行・再発大腸癌の1st-lineにおけるFOLFIRI + Cetuximab療法はFOLFIRI + Bevacizumab療法と比較して、臨床的に意味のあるOSの延長を認めた (中央値で3.7ヵ月の差、HR=0.77)。主要評価項目であるITT集団での奏効率は両群に有意差を認めなかったが、奏効評価可能集団に限定するとCetuximab群で奏効率が高い傾向にあった。毒性プロファイルは想定範囲内で忍容可能であった。
コメント
本研究は、KRAS 野生型のmCRCに対して、フロントラインにおける抗VEGF抗体薬または抗EGFR抗体薬の併用療法のどちらが有用であるか?など興味がもたれていたことに加え、本年1月のGastrointestinal Cancers Symposiumにおいて1st-lineのPEAK試験1)、2nd-lineのSPIRITT試験2) が発表され、本会の目玉の1つとして大きな関心が持たれていた。
結果は上述の如くであり、主要評価項目の奏効率において有意差を証明できず、negative studyと言わざるを得ない。一方、副次評価項目のOSでは、Cetuximabの上乗せが3.8ヵ月、HR=0.77と統計学的な有意差が認められた。OSのグラフをみても24ヵ月頃から各群の曲線は明らかに開いているが、有意差が得られた理由は不明である。ディスカッサントも”What is happening after 24 M?”と解釈に苦労する結果であったが、1つの理由として、Cetuximab群の腫瘍縮小効果は非常に強く、Bevacizumabの縮小効果との間に大きな差があり、ここからOSの有意差が生じた可能性を示した。しかし、この仮説については、今後の中央評価判定によるサブ解析の結果を待つ必要がある。また、Bevacizumab群では2nd-lineでBBPできていたのは17.8%と、TML試験3) で認められた効果が得られていたか等の問題も多い。
今回の試験結果をもって、すべてが変わるかどうかの判断は時期尚早と思われるが、第III相比較試験においてOSに有意差が認められたという事実は重く、そう簡単にnegative study として片付けるわけにはいかない。やはり結論は、本試験の詳細なsub解析や、CALGB80405試験の結果などを待って判断すべきであろう。
(レポート:谷口 浩也 監修・コメント:小松 嘉人)
- Reference
-
- 1) Schwartzberg LS, et al.: 2013 Gastrointestinal Cancers Symposium: abst #446
- 2) Hecht JR, et al.: 2013 Gastrointestinal Cancers Symposium: abst #454
- 3) Arnold D, et al.: 2012 Annual Meeting of the American Society of Clinical Oncology®: abst #CRA3503