CRYSTAL試験、OPUS試験、NCIC CTG CO. 17試験という3本の独立した臨床試験の結果から、KRAS statusが抗EGFR抗体薬のひとつであるCetuximabの治療効果ときわめて密接な関係があることが明らかにされ、KRAS 野生型の大腸癌におけるCetuximabの有意の効果については一点の疑問も差し挟む余地がないようにみえる。ただしここで注意しなければならないのは、上記の3試験とも、当初のプロトコールにKRAS statusによる比較を行うことがあらかじめ記載されていない点である。すなわち上記の3試験においては、症例登録が終了した後に研究計画を変更し、改めてInstitutional Review Committee (治験審査委員会) に申請をし直して組織標本を集め、KRAS statusを調査し、Cetuximabの有用性を検証した後解析の結果であるということを明確にしておかねばならない。Design-basedで前もって仮説を立て、それを前向きに評価するというprincipleとは異なったアプローチがとられているわけである。したがって、CRYSTAL試験、OPUS試験、NCIC CTG CO. 17試験の3試験で示唆されたKRAS 野生型症例におけるCetuximabの有用性については、今一度臨床試験のプロトコールの段階でKRAS 野生型に関する仮説を明記し、それを検証するという前向き臨床試験によるプロセスが必要不可欠であることを認識すべきであろう。
 N0147試験、NORDIC VII試験、COIN試験
N0147試験、NORDIC VII試験、COIN試験
――KRAS 野生型における効果を前向きに検討した試験ではnegativeな結果に
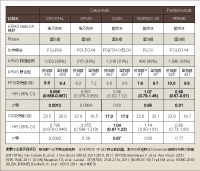
大腸癌術後補助化学療法におけるKRAS statusと予後の関連を評価したN0147試験では、治癒切除後のKRAS 野生型大腸癌1,864例がmFOLFOX6群 (909例) とCetuximab併用群 (955例) に無作為に割り付けられた10)。3年disease-free survival (DFS) は、mFOLFOX6群がCetuximab併用群よりも良好な成績であり (mFOLFOX6群: 75.8%, Cetuximab併用群: 72.3%、HR=1.2, 95% CI: 0.96-1.5, p=0.22)、OSについてもCetuximabの上乗せ効果は認められていない。毒性についても、Cetuximab併用群ではmFOLFOX6群に比べてGrade 3以上の皮疹、下痢、好中球数減少などの有害事象の発現頻度が高く、治療完遂率はCetuximab併用群で有意に低下していた (mFOLFOX6群: 77.3%, Cetuximab併用群: 65.6%, p<0.001)。すなわちFOLFOXとCetuximabを併用した補助療法については、あらかじめ対象をKRAS 野生型に絞り込んで臨床試験を行ったにもかかわらず、明らかにnegativeな結果が得られている。
また、転移を有する進行再発大腸癌566例に対して1st-lineでFLOXとCetuximabの併用を検討した無作為化比較試験 (NORDIC VII試験) では、PFSにおいてKRAS 野生型でCetuximab併用群がFLOX単独群に比較してやや劣る傾向がみられたのに対し、KRAS 変異型では逆にCetuximab併用群が良好な成績を示していた11)。
さらに解釈を困難にしたのは、英国MRCによって行われたCOIN試験の結果である。この試験ではKRAS 野生型729例を化学療法 (FOLFOX / XELOX) 単独A群367例と化学療法 + Cetuximab併用B群362例に無作為割付して比較を行っているが、主要評価項目であるOSはA群17.9ヵ月、B群17.0ヵ月 (HR=1.04, 95%CI: 0.87-1.23, p=0.67) であり、両群間には全く差が認められていない12)。PFSについても全く同様の結果であり、CRYSTAL試験、OPUS試験、NCIC CTG CO.17試験の3試験の後解析で得られたKRAS 野生型に対するCetuximabの上乗せ効果を前向き臨床試験において証明しようとした上記3試験は、すべてnegativeな結果となってしまっている。
このように探索的な後解析で得られたKRAS 野生型に対するCetuximabの有用性は、それを補助療法、進行癌に対する治療の双方で確認しようと試みられたプロスペクティブな3試験においては証明されていない。こうした前向き試験の結果を受けて、NCCNガイドラインでは進行再発大腸癌の治療アルゴリズムからXELOX + Cetuximab (2010年)、FOLFOX + Cetuximab (2012年) を削除した。
 Cetuximabの併用効果に関するプロスペクティブな検証は未だ不十分
Cetuximabの併用効果に関するプロスペクティブな検証は未だ不十分
それでは、EGFRに対する分子標的薬や抗体薬のKRAS 野生型における効果は否定されるべきなのであろうか? ひとつはCetuximabに併用する化学療法のcounterpart (Oxaliplatin / CPT-11) によって違いがある可能性は否定できない。KRAS 野生型症例に対するCetuximabの有用性の根拠となっているCRYSTAL試験の化学療法はFOLFIRI療法であったにもかかわらず、3本の前向き試験ではいずれもOxaliplatinベースの化学療法が用いられ、未だにCetuximabとCPT-11の併用効果に関する踏み込んだ検討はなされていない。CRYSTAL試験の探索的な後解析で示唆された、KRAS 野生型に対するCetuximabの併用効果に関する前向きな検証はまだ終わっていないということもできる。
一方、Cetuximabと同様の抗EGFR抗体薬ではあるが完全ヒト型のモノクローナル抗体であるPanitumumabについて行われたPRIME試験では、656例のKRAS 野生型大腸癌のうち、331例でFOLFOX4単独療法、325例でFOLFOX4 + Panitumumab療法が行われている13)。最終解析の結果、主要評価項目であるPFSはFOLFOX4群で8.6ヵ月、Panitumumab併用群では10.0ヵ月 (HR=0.80, 95% CI: 0.67-0.97, p=0.01) であり14)、Panitumumabの併用がKRAS 野生型の切除不能進行・再発大腸癌において有意の効果を示していることが確認されている。
このように、KRAS 野生型に対する抗EGFRモノクローナル抗体の効果については、Cetuximabでは後解析でその有用性が示唆されたにもかかわらず、その仮説を検証するために行われた3本の前向き試験における確認が成功できていない。これに対し、PanitumumabのKRAS 野生型に対する効果を証明したPRIME研究は前向きの臨床試験であり、この試験でPanitumumabの有意の効果が示されたことは意義深く、示唆に富んだ結果であると考えることができる (表)。キメラ抗体であるCetuximabに対し、Panitumumabは完全ヒト型抗体であり、上に述べたいくつかの臨床試験の結果が両者の間で異なっているのは、抗体医薬の特性によるものである可能性もある。
前向き臨床試験のなかで、治療効果が発揮されるサブセットを探索する試みは優れた研究手法であり、CRYSTAL試験でのKRAS statusによるレトロスペクティブな解析がもたらした仮説はきわめて重要なものであったといえる。問題は、その後解析によって示唆された仮説を検証するために行われたいくつかの臨床試験において、Panitumumabでは確認された事実がCetuximabでは有意の結果として証明されていないことであり、さらなる臨床試験――可能ならばFOLFIRIまたはCPT-11との併用での――が行われることによって、この問題に関するより正確な解答が得られるものと期待している。