CPT-11+Bevacizumab
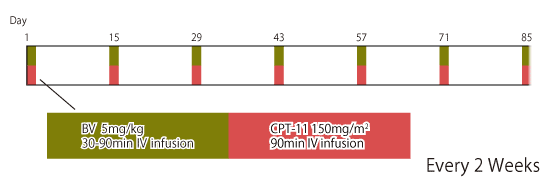 |
|
*CPT-11の結腸・直腸癌における国内承認用量は150mg/m2である。ただし、投与量は、年齢、症状により適宜増減する。 |
Yamazaki K, et al. Ann Oncol. 27(8): 1539-1546, 2016 |
WJOG4407G試験1)で1次治療におけるFOLFOX+Bevacizumab(BV)に対するFOLFIRI+BVの非劣性が検証され、FOLFIRI+BVは2次治療でも標準治療と認識されている。一方で、1次治療で不応となったフッ化ピリミジンを2次治療でも継続投与することは標準治療ではあるものの、継続投与による生存期間延長は検証されていない。実地臨床においては、毒性軽減の観点から5-FU/LVを中止してCPT-11+BVとして投与することは治療選択肢のひとつとなり得る。本レジメンは本邦で行われた第II相試験2)(BVは10mg/kg)で有効性と安全性が確認されている。
◆WJOG4407G試験
切除不能進行・再発大腸癌患者における1次治療としてのFOLFOX+BV(n=200)に対するFOLFIRI+BV(n=202)の非劣性を検証した第III相試験である。
■有効性
主要評価項目であるPFSは、FOLFIRI群の中央値12.1ヵ月、FOLFOX群の中央値10.7ヵ月であり(HR 0.91, 95% CI: 0.72-1.13, pnon-inferiority=0.003)、FOLFOX群に対するFOLFIRI群の非劣性が検証された。
副次的評価項目(FOLFIRI群/FOLFOX群)であるOSは、中央値31.4/30.1ヵ月、奏効割合は64/62%であり、同程度であった。
| FOLFIRI+BV (n=202) |
FOLFOX+BV (n=200) |
HR (95% CI) |
p値 | |
| PFS | 12.1ヵ月 | 10.7ヵ月 | 0.91 (0.72-1.13) |
0.003 (non-inferiority) |
| OS | 31.4ヵ月 | 30.1ヵ月 | 0.99 (0.79-1.25) |
0.73 |
| 奏効割合 | 64% | 62% | − | 0.76 |
■安全性
Grade 3以上の有害事象(FOLFIRI群/FOLFOX群)は、好中球減少(46/35%)はFOLFIRI群で有意に多く、末梢神経障害(0/22%)はFOLFOX群にのみ認められた。
2次治療としてのFOLFIRI(n=42)とCPT-11単剤(n=43、350mg/m2/3weeks)を比較する第II相試験(DaVINCI試験3))における有効性(FOLFIRI/CPT-11)は、PFS中央値6.2/4.0ヵ月(HR 0.81, p=0.34)、OS中央値15.4/11.2ヵ月(HR 0.72, p=0.14)であり、ややFOLFIRIで良好な傾向であったが、有意差は認めず、奏効割合は11/11%と同程度であった。この結果より、フッ化ピリミジンの1次−2次治療継続投与により生存期間延長が得られると結論付けることはできない。よって、患者の状態などに応じて、FOLFIRI+BVとCPT-11+BVのどちらのレジメンも選択可能と考えられる。
なお、本邦で行われた2次治療としてのCPT-11+BV(n=30)の第II相試験では、有効性(PFS中央値5.7ヵ月、OS中央値11.8ヵ月、奏効割合7%、病勢制御割合87%)、安全性(grade 3以上の有害事象:好中球減少50%、発熱性好中球減少症7%、食思不振7%、下痢3%)が確認されている。
レジメン解説執筆:愛知県がんセンター中央病院 薬物療法部 加藤 恭子 先生/舛石 俊樹 先生
References
GI cancer-net
消化器癌治療の広場
