背景と目的
5-FU、L-OHP、CPT-11、Bevacizumab、抗EGFR抗体薬 (RAS 野生型) による化学療法に抵抗性となった切除不能進行・再発大腸癌に対し、RegorafenibならびにTAS-102の有効性がプラセボ比較第III相試験により証明されている1,2)。一方、Bevacizumabは1st-line投与後の2nd-lineにおける継続投与の有効性が示されており3)、前臨床試験においてBevacizumabとTAS-102併用は、それぞれの単剤投与と比較して抗腫瘍効果を増強することが報告されている4)。
今回、本邦におけるTAS-102とBevacizumab併用療法の至適投与量と有効性・安全性を評価するため、医師主導第I/II相試験が報告された。
対象と方法
対象は、5-FU、L-OHP、CPT-11、抗VEGF抗体薬 (Bevacizumab等)、抗EGFR抗体薬 (RAS 野生型の場合) を含む抗癌剤治療に不応・不耐となり、Regorafenib、TAS-102による治療歴のない大腸癌患者である。
主要評価項目は、第I相部分が安全性と第II相試験での推奨用量の決定、第II相部分が中央判定での16週時点のPFSとした。PFSの期待値を50%、閾値を25%、α=0.1、β=0.2から、第II相部分の必要症例数は21例と算出された。
結果
2014年2月~7月までに25例が登録された。第I相部分 (n=6) において用量制限毒性を認めず、推奨用量はTAS-102が35mg/m2 1日2回、day1-5, day8-12、Bevacizumabが5mg day1, 15、4週毎と決定された。
主解析は21例 (第I相部分の6例を含み、主解析後に登録された4例を除く) で行われ、16週PFSは42.9% (80% CI: 27.8- 59.0) であり、主要評価目標を達成した。
副次評価項目 (対象:全登録例25例) の16週PFS (担当医評価) は60.0% (95% CI: 38.7-78.9) であった。また、担当医評価によるPFS中央値は24.1週 (95% CI: 15.0-32.0) (図1)、病勢コントロール率は72% (95% CI: 50.6-87.9) であり、中央判定ではそれぞれ16.3週 (95% CI: 8.6-23.6)、64% (95% CI: 42.5-82.0) であった。
図1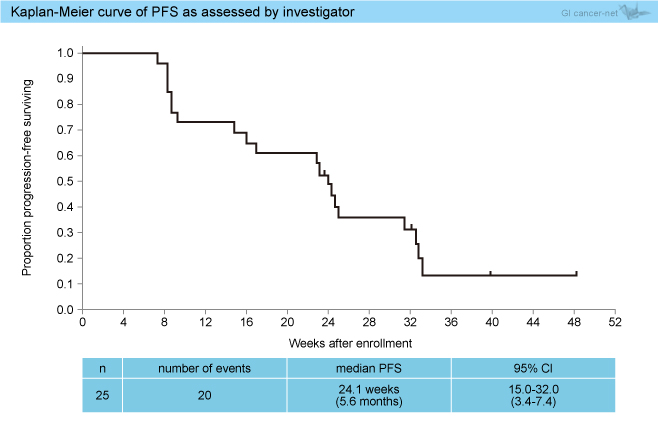
後治療は80%の患者で行われ (70%はRegorafenib)、OS中央値は48.6週 (95% CI: 32.0-未到達) であった (図2)。
図2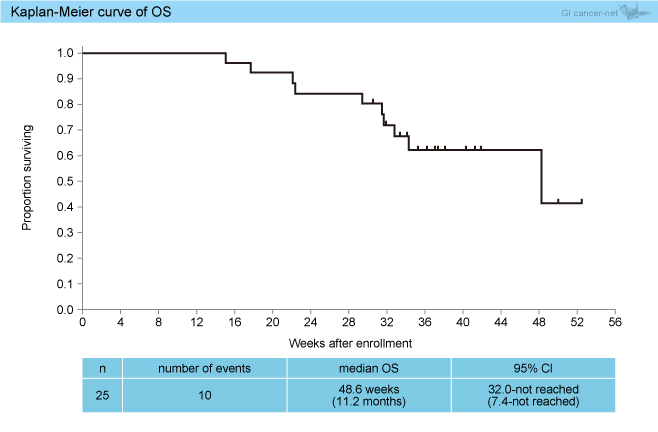
薬剤関連有害事象として好中球減少 (grade 3: 56%, grade 4: 12%)、白血球減少 (grade 3: 40%)、発熱性好中球減少症 (grade 3: 16%) が多かったが (表1)、治療関連死は認められなかった。
サイクル数中央値は5サイクル (範囲:2-11) であった。17例 (68%) で治療開始延期が、6例 (24%) でTAS-102の減量が必要であり、その理由の多くは好中球減少であった。
表1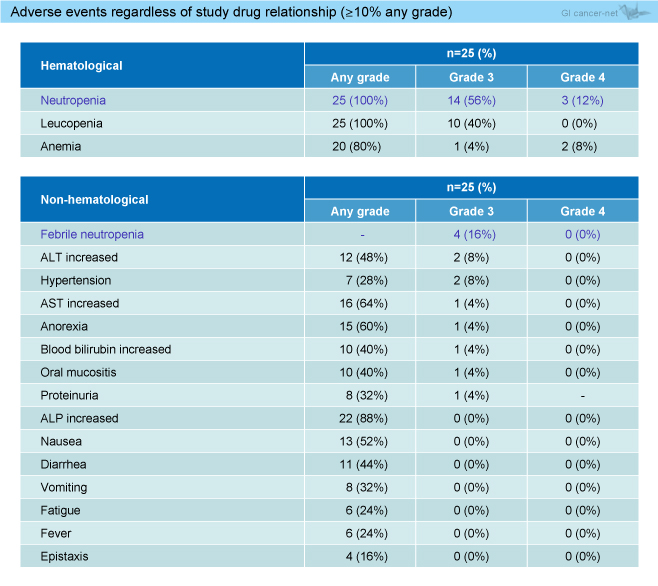
結論
標準治療不応後の切除不能進行・再発大腸癌に対するTAS-102 + Bevacizumab療法は有効性が認められ、毒性も許容範囲内であることから、さらなる検討に値する。今後バイオマーカー解析が予定されている。
コメント
過去に行われたTAS-102単剤の試験であるRECOURSE試験ではPFS中央値2.0ヵ月、OS中央値7.1ヵ月1)、Regorafenibの試験であるCORRECT試験ではそれぞれ1.9ヵ月、6.4ヵ月であった2)。これらと直接比較することはできないものの、本試験でのPFS中央値5.6ヵ月およびOS中央値11.2ヵ月は、両試験よりも延長していることから、本試験結果に注目が集まった。臨床現場からはTAS-102承認時より、前治療においてBevacizumabを併用していた症例に対するBBP (Bevacizumab Beyond Progression) 戦略から、Bevacizumabを中止することなくTAS-102と併用することによる、さらなる生存延長に期待があった。RECOURSE試験での病勢コントロール率が44%であるのに対し、本試験での病勢コントロール率が64%と上昇していることも、TAS-102への変更後の早期増悪を避けることへの期待につながっている。本試験結果からいえることは、TAS-102とBevacizumab併用の忍容性が確認されたことである。有効性確認のためには、単剤と比較した検証試験が必要となるが、実臨床では研究的治療として、3rd-line以降の治療オプションの候補になりうると考える。
(レポート:谷口 浩也 監修・コメント:佐藤 温)


