背景と目的
FOLFOX + Bevacizumab (Bev) やCapeOx + BevといったBev併用の化学療法は標準治療の1つとして受け入れられているが、その治療継続期間については未だ議論の余地がある。フッ化ピリミジン系製剤 (FP) + Bevを維持療法として用いることについては、Bevを併用していない化学療法のみの試験であるOPTIMOX1, 2試験1,2) 等の結果から広く受け入れられており、NO16966試験などの臨床試験において標準治療アームとして用いられている3)。抗癌剤の種類を減らす維持療法について様々なレジメンで評価されているが、明確な標準治療を決定できていない4-6)。
本試験 (AIO 0207) では、FP + L-OHP + Bevを24週間併用する標準的な導入療法後、維持療法として化学療法を継続しない群 (無治療群) もしくはBevのみ継続する群 (Bev群) の、FP + Bevを継続する群 (FP + Bev群) に対する非劣性について、維持療法に続けて予定されたFP + L-OHP + Bev療法の再導入までを治療戦略の全体として検討した。
対象と方法
本試験には、病理学的に切除不能進行・再発大腸癌 (mCRC) と診断され、治癒切除のオプションがなく、FP + L-OHP + Bevの導入療法を24週実施後SD以上である“標準的な”適格基準をみたす患者が登録され、FP + Bev群、Bev群、無治療群の3群に無作為に割り付けられた (図1)。なお、導入療法におけるFPは、主治医判断により標準的な治療法 (例: 5-FU/LV、Capecitabinなど) が選択された。
維持療法は、許容できない有害事象もしくは患者拒否、維持療法が患者のメリットにならないとみなされる場合以外は、PDが確認されるまで継続された。抗腫瘍効果および毒性は6週毎に評価され、初回PDにおけるFP + L-OHP + Bev療法の計画的再導入までがプロトコール治療とされた。
図1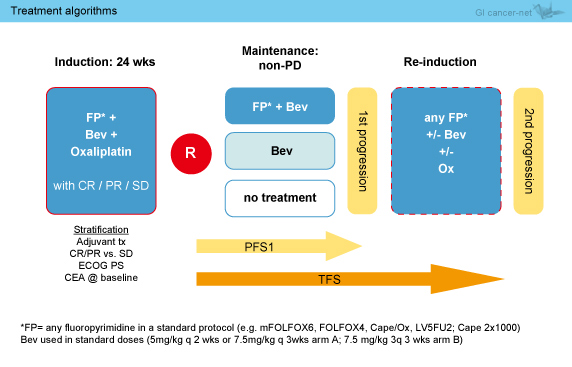
主要評価項目は "time to failure of strategy (TFS) "とした。TFSは「無作為化された時点から維持療法および再導入後2度目のPDまでの期間」と定義され、再導入されない場合は「2nd-line治療として新規薬剤を使用した時点もしくは後治療を継続しない時点までの期間」と定義される。副次評価項目は、無作為化から初回PDまでの期間 (PFS1)、OS、毒性、QOL、バイオマーカーなどである。
必要症例数は、それぞれの試験治療群が独立して、標準アームであるFP + Bev 群に対する非劣性が推定されるよう計算された (片側α=0.0125, 検出力80%)。非劣性マージンは、TFS中央値の信頼区間が3.5ヵ月で棄却されるように設定され、標準治療群のTFS中央値は5ヵ月とみなし、これはHR=1.43に相当する。Time-to-event curveはlog-rank検定を用いて比較した。
結果
2009年9月~2013年2月までにドイツの106施設から837例が登録され、476例が無作為化され3群に割り付けられた (図2)。登録症例のうち、42%は無作為化されず脱落したが、その主な理由はPDであった。追跡期間中央値は21.3ヵ月であり、無作為化された症例のうち95%で維持療法が完了していた。
図2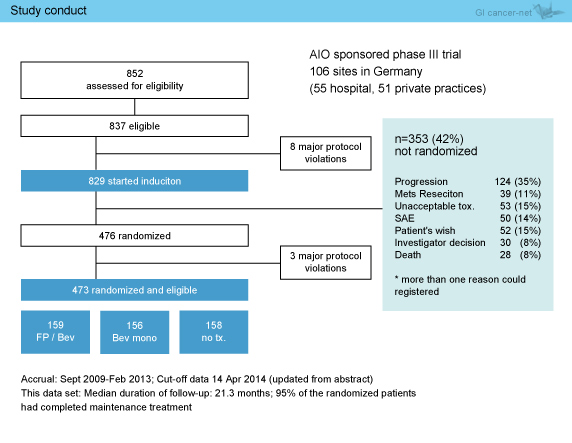
導入療法におけるFPの割合は、5-FU 84%、Capecitabine 16%であった (表1)。また、導入療法24週時点で既にL-OHPが休薬されていた症例は16%であり、CR/PRは44%、SDは28%であった。その他、患者背景に偏りはみられなかった (表2)。
表1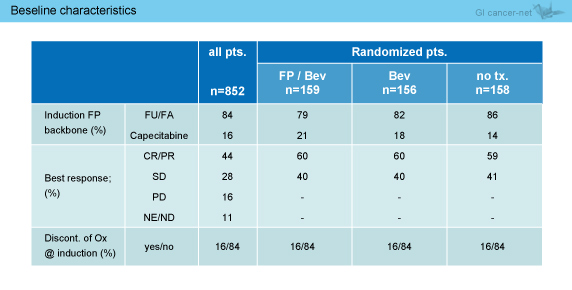
表2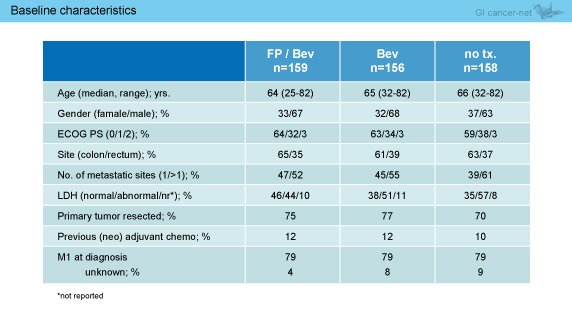
主要評価項目であるTFSの中央値は全体で6.5ヵ月であり、FP + Bev群6.8ヵ月、Bev群6.5ヵ月、無治療群 6.1ヵ月であった (図3)。FP + Bev群に対するBev群はHR=0.98 (95% CI: 0.76-1.26) であり、非劣性が証明された。また、FP + Bev群に対する無治療群はHR=1.22 (95% CI: 0.96-1.57) とFP + Bev群で良好な傾向にあり、非劣性は証明されなかった。
図3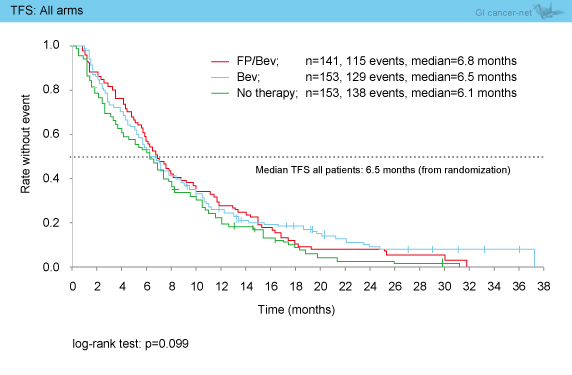
PFS1中央値は、FP + Bev群6.2ヵ月、Bev群4.8ヵ月、無治療群3.6ヵ月であった。FP + Bev群に対するBev群はHR=1.21 (95% CI: 0.95-1.56) であった。また、FP + Bev群に対する無治療群はHR=2.06 (95% CI: 1.60-2.66) と、FP + Bev群で良好な結果であった (図4)。
図4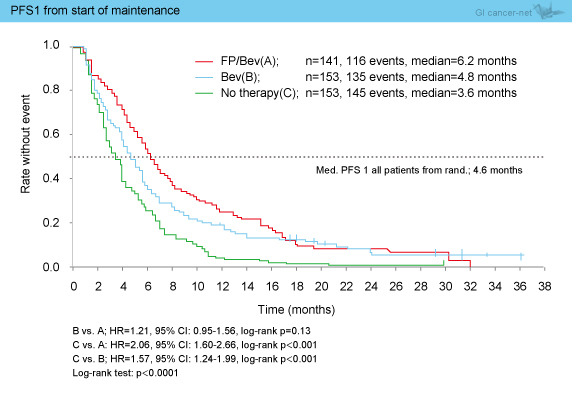
維持療法の中止理由において、PDのため中止となった割合がFP/Bev群では他の2群に比べて低く (58% vs. 79% vs. 86%)、忍容できない毒性(8% vs. 5% vs. 1%) や患者希望 (20% vs. 7 % vs. 7%) が多かった (表3)。
表3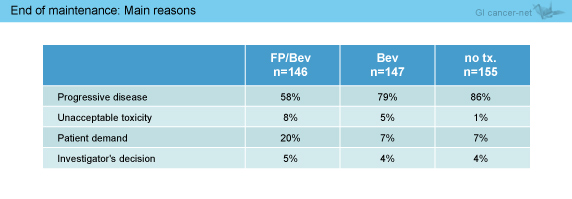
維持療法期間中の毒性として、FP + Bev群およびBev単剤群ともにgrade 3の末梢神経障害は13%であったが、その他のgrade 3以上の有害事象はすべて5%未満であった (表4)。
表4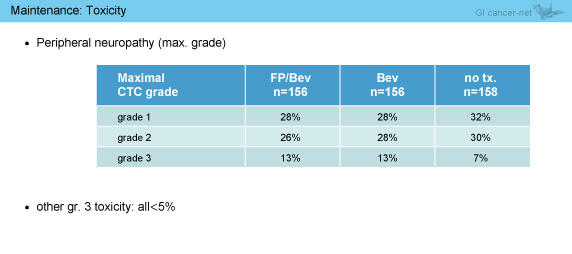
初回PDにおける再導入率は全体でも37%であり、FP + Bev群21%、Bev群43%、無治療群45%であり、FP + Bev群での再導入率は低値であった (図5)。
図5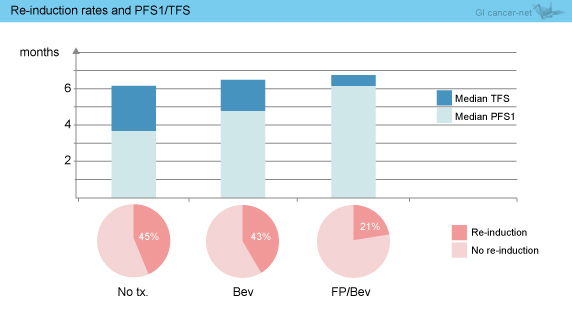
203のイベントが報告され、維持療法の開始からのpreliminaryなOSは全体では23.7ヵ月であり、各群における有意差は認められなかった (FP + Bev群23.8ヵ月、Bev群26.2ヵ月、無治療群23.1ヵ月 : p=0.70) (図6)。
図6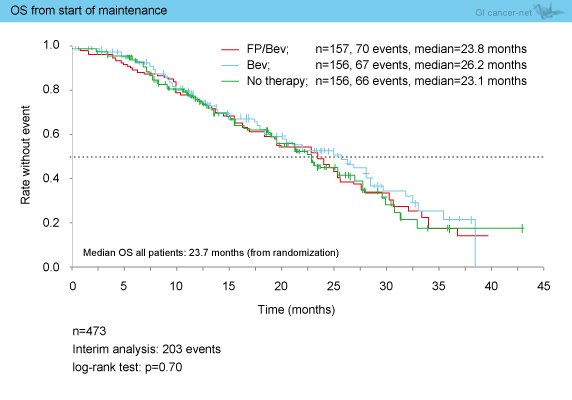
結論
FP + L-OHP + Bevの導入療法を6ヵ月実施後に維持療法を行い、初回PD例には再導入するという治療戦略は、臨床試験という状況においても完遂例は少なかった。PFS1延長を目指すのであれば、FP + Bev療法は最良の治療オプションであった。
将来的に、”moderately active (適度に有効)”で有症状の毒性がない維持療法は、治療成績を改善する可能性があり、評価されるべきである。
コメント
CAIRO3試験7)と同様、切除不能進行・再発大腸癌の化学療法における無治療期間 (chemotherapy-free intervals) の評価に関する報告である。殺細胞性抗癌剤+分子標的薬、分子標的薬のみ、化学療法なし (chemo-holiday) の3群での比較であり、最も興味のある選択肢比較となっている。本試験では、主要評価項目がOSではなく、治療成功期間での非劣性試験となっているが、一方ではQOL評価まで行われている。結果は近接した値ではあるものの、殺細胞性抗癌剤 + 分子標的薬を維持療法として推奨している。
ディスカッサントの意見は、維持療法の意義にまで踏み込み、維持療法期間自体が患者にとって何の意味を持つものであるのかを問いかけた。Chemo-holidayは患者に対して経済的負担を削減し、治療による時間的拘束や薬物による副作用の苦痛から開放することが期待される。それらのメリットと推定されるOS延長への効果を天秤に測ることから考えるべきである。これは、癌医療の原点を思い起こさせるものであり、大切にしたいマインドである。患者視点で考えると、本試験およびCAIRO3試験はともに、chemo-holidayを肯定できる内容とも言える。実臨床では症例毎の対応となることは言うまでもないが、インフォームドコンセントにおいては試験結果を熟知した情報を提供し、EBMだけではなくNBM (narrative-based medicine) にも大きく配慮すべきと学習した。
(レポート:坂井 大介 監修・コメント:佐藤 温)
- Reference
-
- 1) Tournigand C, et al.: J Clin Oncol. 24(3): 394-400, 2006[PubMed]
- 2) Chibaudel B, et al.: J Clin Oncol. 27(34): 5727-5733, 2009[PubMed]
- 3) Saltz LB, et al.: J Clin Oncol. 26(12): 2013-2019, 2008[PubMed]
- 4) Koopman D, et al.: 2014 Gastrointestinal Cancers Symposium, abst #388[学会レポート]
- 5) Koeberle M, et al.: 2013 Annual Meeting of the American Society of Clinical Oncology®: abst #3503[学会レポート]
- 6) Ylcin S, et al.: J Clin Oncol. 85(6): 328-335, 2013[PubMed]
- 7) Koopman D, et al.: 2014 Annual Meeting of the American Society of Clinical Oncology®: abst #3504[学会レポート]


