ESMO 2014 Congress
大腸癌
Abstract #LBA11
FIRE-3試験の最終的RAS 評価可能集団における客観的奏効、早期腫瘍縮小、奏効の深さの独立画像評価
Independent Radiological Evaluation of Objective Response, Early Tumor Shrinkage, and Depth of Response in FIRE-3 (AIO KRK-0306) in the Final RAS Evaluable Population
Sebastian Stintzing, et al.

Expert's view

篠崎 英司 先生
がん研有明病院
消化器内科・
化学療法科
RAS 解析は最終的にITT群の80.2%で行われた。CALGB80405試験のRAS 解析の発表が50%台であったことと比較すると対照的である。「The New England Journal of Medicine」誌に発表されたPanitumumabのRAS 解析の発表1)以来、RAS 野生型が抗EGFR抗体薬のresponderをenrichすることはすでにコンセンサスのようになっているが、実際に今回の発表でも独立画像評価の対象症例においてCetuximab群の奏効率、ETS、DpRに関してKRAS exon 2野生型よりRAS 野生型のほうがより良くresponderをenrichし、Bevacizumab群と比較してその差を広げる結果となっている。概ね奏効率で15%、ETSで20%、DpRで15%の上乗せがみられた。一方、PFS中央値はRAS 野生型にenrichしても全く差がなく、曲線は綺麗に一致している。そして、議論となるOS中央値の差はRAS の絞り込みにより8.1ヵ月 (HR=0.697) にまで広がった。
CALGB80405試験の結果を知らなければ、この試験をもってRAS 解析による非常に明確な分子標的薬の使い分けが確立していたものと思われるが、現状はCALGB80405試験からOSの優位性がcontroversialである以上、今後の追加報告や直接比較試験のpooled analysisで一定の見解が出るのを待つ他はなさそうである。今回、CALGB80405試験と合わせたdiscussionにおいて異例の複数人のコメンテーターが登壇し、抗EGFR抗体薬がRAS 野生型では若干良さそうだという趣旨のコメントもあったが、本邦の実臨床においては、優位性が明確である腫瘍縮小を期待すべき症例では抗EGFR抗体薬がpreferというバイオマーカーより、治療goalや毒性のpreferenceを重視する、従来の治療選択を踏襲することとなりそうである。
FIRE-3試験は、KRAS exon 2野生型の切除不能進行・再発大腸癌に対する1st-lineとしてのFOLFIRI + CetuximabとFOLFIRI + Bevacizumabを比較する無作為化試験である。ITT集団 (592例) では、主要評価項目である奏効率はCetuximab群62%、Bevacizumab群58%であり (p=0.183)、PFS中央値もそれぞれ10.0ヵ月、10.3ヵ月と両群に有意差を認めなかったが (p=0.547)、OS中央値はCetuximab群28.7ヵ月、Bevacizumab群25.0ヵ月とCetuximab群で有意な延長を認めた (HR=0.77, p=0.017)。
事前に計画されていたバイオマーカー解析では、最終的に475例 (80.2%) でRAS 評価が可能であり、400例がRAS 野生型であった。KRAS exon 2野生型における遺伝子変異は、KRAS exon 3 (codon 59, 61) が4.0%、exon 4 (codon 117, 146) が5.9%、NRAS exon 2 (codon 12, 13) が3.6%、exon 3 (codon 59, 61) が2.1%、exon 4 (codon 117, 146) が0.2%であった。最終的RAS 野生型におけるOS中央値は、Cetuximab群33.1ヵ月、Bevacizumab群25.0ヵ月であり、Cetuximab群で8.1ヵ月の延長を認めた (HR=0.697, 95% CI: 0.54-0.90, p=0.0059) (図1)。
本解析では、独立の画像評価により、奏効、早期腫瘍縮小 (early tumor shrinkage: ETS)、奏効の深さ (depth of response: DpR) の検討を行った。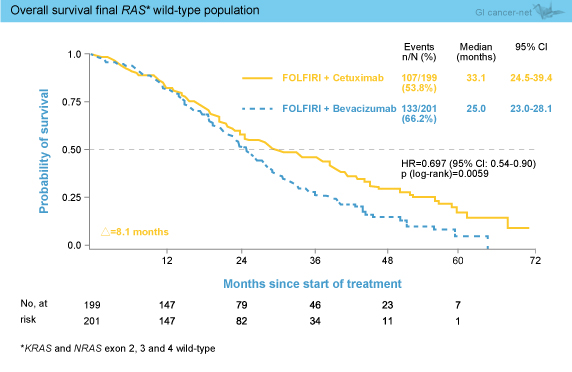
事前に計画されていたバイオマーカー解析では、最終的に475例 (80.2%) でRAS 評価が可能であり、400例がRAS 野生型であった。KRAS exon 2野生型における遺伝子変異は、KRAS exon 3 (codon 59, 61) が4.0%、exon 4 (codon 117, 146) が5.9%、NRAS exon 2 (codon 12, 13) が3.6%、exon 3 (codon 59, 61) が2.1%、exon 4 (codon 117, 146) が0.2%であった。最終的RAS 野生型におけるOS中央値は、Cetuximab群33.1ヵ月、Bevacizumab群25.0ヵ月であり、Cetuximab群で8.1ヵ月の延長を認めた (HR=0.697, 95% CI: 0.54-0.90, p=0.0059) (図1)。
本解析では、独立の画像評価により、奏効、早期腫瘍縮小 (early tumor shrinkage: ETS)、奏効の深さ (depth of response: DpR) の検討を行った。
図1

独立画像評価は、治療割り付け情報のマスク下に中央判定で行われた。奏効の判定にはRECIST ver. 1.1を用い、ETSは初回CT検査 (6週) で腫瘍径がベースラインに比べ20%以上縮小した場合、DpRはベースラインからの最大腫瘍縮小率と定義した。ITT集団におけるRECIST評価可能例は493例 (83%、Cetuximab群236例、Bevacizumab群257例)、最終的RAS 野生型集団のCT評価可能例は330例 (83%、157例、173例) であった。
独立画像評価における奏効率は、KRAS exon 2野生型 (66.5 vs. 55.6%, OR=1.58, 95% CI: 1.10-2.28, p=0.016) および最終的RAS 野生型 (72.0 vs. 56.1%, OR=2.01, 95% CI: 1.27-3.19, p=0.003) のいずれもCetuximab群が有意に良好であった。
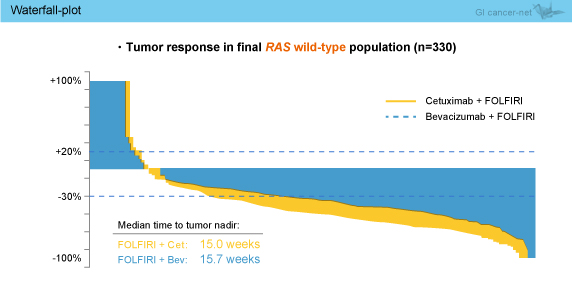
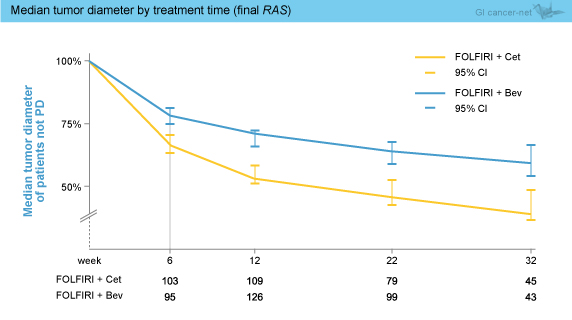
ETSにおいても、KRAS exon 2野生型 (62.3 vs. 47.9%, OR=1.80, 95% CI: 1.26-2.58, p=0.0015) および最終的RAS 野生型 (68.2 vs. 49.1%, OR=2.22, 95% CI: 1.41-3.47, p=0.0005) のいずれもCetuximab群が有意に良好であった。なお、両群ともに、ETS達成例は非達成例に比べPFSおよびOSが有意に良好であった (表)。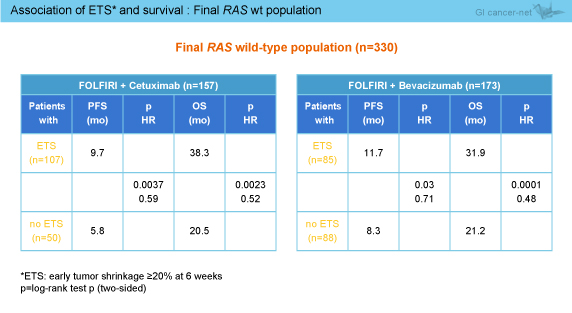 また、DpRにおいても、KRAS exon 2野生型 (-44.1 vs. -32.9%, p=0.0003) および最終的RAS 野生型 (-48.9 vs. -32.3%, p<0.0001) のいずれもCetuximab群が有意に良好であり、DpRはPFSやOSと有意に相関することが示された (両側Bravais Pearson検定)。最終的RAS 野生型のwaterfall plot解析では、全般にCetuximab群の奏効が深く (図2)、非PD例の腫瘍径中央値は、経時的に一貫してCetuximab群で小さい傾向が認められた (図3)。
また、DpRにおいても、KRAS exon 2野生型 (-44.1 vs. -32.9%, p=0.0003) および最終的RAS 野生型 (-48.9 vs. -32.3%, p<0.0001) のいずれもCetuximab群が有意に良好であり、DpRはPFSやOSと有意に相関することが示された (両側Bravais Pearson検定)。最終的RAS 野生型のwaterfall plot解析では、全般にCetuximab群の奏効が深く (図2)、非PD例の腫瘍径中央値は、経時的に一貫してCetuximab群で小さい傾向が認められた (図3)。
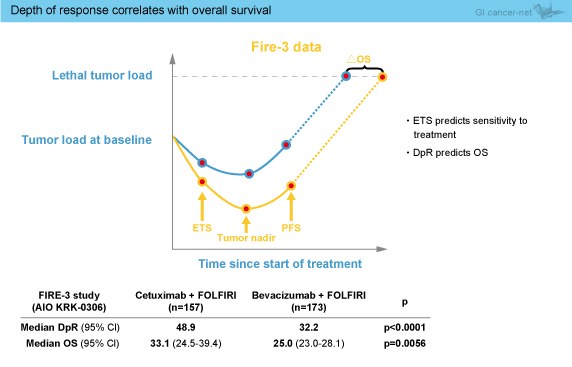
 FOLFIRIに対するCetuximabの上乗せ効果を検討したCRYSTAL試験では、ETSは治療の感度を予測し、DpRの予測因子である可能性があり、DpRはOSの予測因子であることが示唆されている。今回のFIRE-3試験の独立画像評価の結果からも、ETSは治療の感度を予測し、DpRはOSの予測因子である可能性が示唆された (図4)。
FOLFIRIに対するCetuximabの上乗せ効果を検討したCRYSTAL試験では、ETSは治療の感度を予測し、DpRの予測因子である可能性があり、DpRはOSの予測因子であることが示唆されている。今回のFIRE-3試験の独立画像評価の結果からも、ETSは治療の感度を予測し、DpRはOSの予測因子である可能性が示唆された (図4)。
ETSにおいても、KRAS exon 2野生型 (62.3 vs. 47.9%, OR=1.80, 95% CI: 1.26-2.58, p=0.0015) および最終的RAS 野生型 (68.2 vs. 49.1%, OR=2.22, 95% CI: 1.41-3.47, p=0.0005) のいずれもCetuximab群が有意に良好であった。なお、両群ともに、ETS達成例は非達成例に比べPFSおよびOSが有意に良好であった (表)。
表

図2

図3

図4

独立画像評価では、FOLFIRI + Cetuximab群はFOLFIRI + Bevacizumab群に比べ奏効率が有意に高く、ETSおよびDpRも優れていた。これら奏効に関連する良好なアウトカムが、FIRE-3試験で認められたFOLFIRI + CetuximabのOSが良好であった理由を部分的に説明する可能性がある。
1) Douillard JY, et al.: N Engl J Med. 369(11): 1023-1034, 2013 [PubMed]
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。

