


進行再発で有効性を示したレジメンが術後補助化学療法に適応されるのが一般的だが、大腸癌の場合、進行再発で有効なIFL、FOLFIRIが術後補助化学療法で有効性を示さなかった。分子標的薬に関しては、進行再発で有効なBevacizumabはAVANT、NSABP-C08で、CetuximabはNCCTG N0147と本試験(PETACC8)でともに上乗せ効果がなかった。これらの結果から、全患者を対象にした場合、結腸癌の術後補助化学療法では分子標的薬の上乗せ効果はないと考えて良い。
また、現時点で分子標的薬の上乗せ効果がない理由は明確になっていない。サブグループ解析においてT4N2でCetuximabの上乗せ効果があるかもしれない、70歳超、右側結腸、女性は逆に悪化させるかもしれないということが発表で述べられたが、いずれも参考程度で実臨床を変えるまでには至らない。
KRAS 遺伝子は個別化治療への第一歩だが、KRAS 野生型といっても腫瘍は均一ではない。今後は、KRAS 野生型のなかでEGFRに依存する腫瘍を見つけ出すという研究が行われ、その絞り込んだ腫瘍を対象に新たに上乗せ効果が検討されることが予想される。よくデザインされた大規模比較試験を対象にTR(translational research)を行うことによって個別化治療の第2段階への道が期待できるので、本試験の結果はnegativeであったが、試験自体は高く評価したい。
なお、#520OではKRAS 野生型に限定する前に登録されたKRAS 変異型における解析が報告された。KRAS 変異型ではCetuximabの効果が期待できないとされているので、上乗せ効果がないという結果は予想通りである。ただし、KRAS 変異型で抗EGFR抗体薬をL-OHPと併用すると効果が減弱される可能性が報告されていたが(OPUS、PRIME)、本試験では効果が減弱していないので、上記の内容を断定することはできなかった。また、FOLFOXの3年DFS (disease-free survival) はKRAS 野生型で78%、KRAS 変異型で71%でありKRAS 遺伝子が予後因子である可能性が示唆された。術後補助化学療法でFOLFOXを使用しているものの、海外のstage III結腸癌の成績も以前より改善していることがうかがえる。
FOLFOX4は治癒切除後のstage III結腸癌における標準的な術後補助化学療法である1, 2)。また、切除不能進行・再発大腸癌においては抗EGFR抗体薬や抗VEGF抗体薬と化学療法を併用することにより治療効果を改善することが示されているが、術後補助化学療法においては改善効果を示すことができていない3-5)。
PETACC8は、治癒切除後のKRAS 野生型stage III結腸癌における術後補助化学療法としてFOLFOX4に対するCetuximabの上乗せ効果を検証する試験である。
対象はKRAS 野生型stage III結腸癌患者であり、術後28〜56日にFOLFOX4群とFOLFOX4 + Cetuximab群とに無作為に割り付けた。主要評価項目はDFSで、副次評価項目はOS (overall survival)、治療コンプライアンス、毒性であった。また、事前に計画されたサブグループ解析が行われた。
KRAS 野生型患者1,602例が登録され、FOLFOX4群(811例)とFOLFOX4 + Cetuximab群(791例)とに無作為に割り付けられた。観察期間中央値はFOLFOX4群3.30年、FOLFOX4 + Cetuximab群3.33年であった。
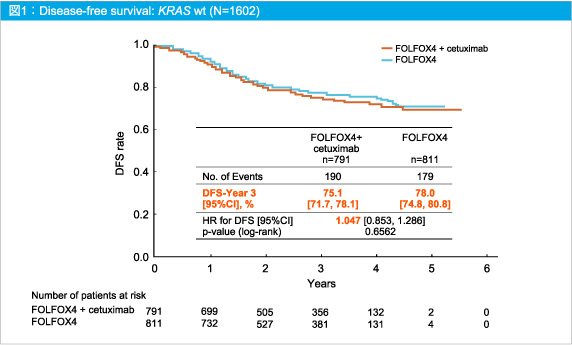
主要評価項目であるDFSは両群間に差はみられず、3年DFSはFOLFOX4群78.0%、FOLFOX4 + Cetuximab群75.1%であった (HR=1.047, 95%CI: 0.853-1.286, p=0.6562) (図1)。
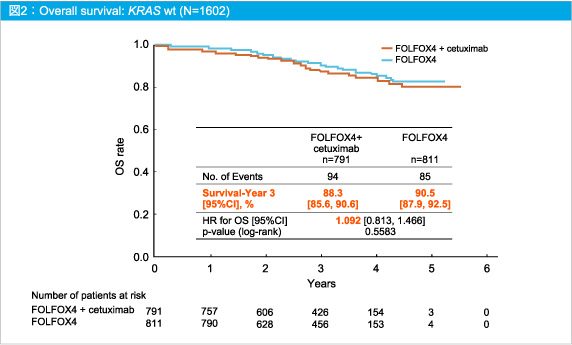
また、3年OSもFOLFOX4群 90.5%、FOLFOX4 + Cetuximab群88.3%と有意差はなかった (HR=1.092, 95%CI: 0.813-1.466, p=0.5583) (図2)。
Grade 3以上の有害事象はFOLFOX4群66.2%、FOLFOX4 + Cetuximab群80.9%であり、FOLFOX4 + Cetuximab群で有意に多かった。主なgrade 3以上の有害事象は皮膚障害、下痢、粘膜炎で、いずれもFOLFOX4 + Cetuximab群で多くみられた。なお、治療中断例はFOLFOX4群21.7%、FOLFOX4 + Cetuximab群28.3%であった。
事前に計画されたサブグループ解析のうち、KRAS /BRAF遺伝子がともに野生型の患者群においても、DFS、OSはKRAS 野生型症例と同様に両群間に有意差は認められなかった。
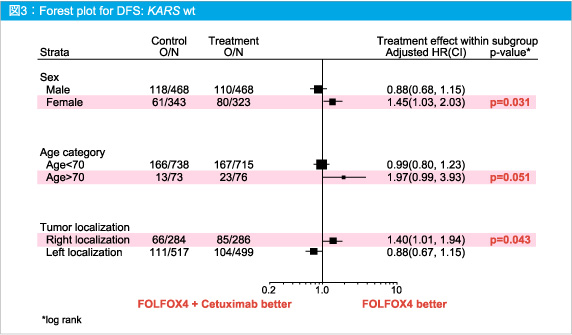
なお、Cetuximab併用によりDFSのベネフィットを得られない症例は、女性 (HR=1.45, 95%CI: 1.03-2.03, p=0.031)、70歳超 (HR=1.97, 95%CI: 0.99-3.93, p=0.051)、右側結腸癌 (HR=1.40, 95%CI, 1.01-1.94, p=0.043) であった (図3)。
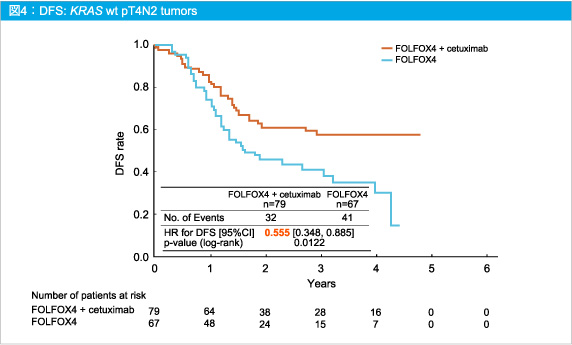
一方、診断時にpT4N2であった症例では、Cetuximab併用によりDFSのベネフィットが得られた (HR=0.555, 95%CI: 0.348-0.885, p=0.0122) (図4)。
治癒切除後のKRAS 野生型またはKRAS /BRAFともに野生型のstage III結腸癌患者において、FOLFOX4にCetuximabを上乗せすることによるDFSおよびOSの改善は認められなかった。なお、サブグループ解析では、Cetuximab併用療法はpT4N2症例に対して治療効果を認めたが、女性、70歳超、右側結腸癌に対しては治療効果を認めなかった。
1) Andre T, et al.: N Engl J Med. 350(23): 2343-2351, 2004 [PubMed]
2) Andre T, et al.: J Clin Oncol. 27(19): 3109-3116, 2009 [PubMed]
3) Aimery de Gramont, et al. 2011 Gastrointestinal Cancers Symposium: abst #362 [学会レポート]
4) Allegra CJ, et al.: J Clin Oncol. 29(1): 11-16, 2011 [PubMed]
5) Alberts SR, et al.: JAMA. 307(13): 1383-1393, 2012 [PubMed]
関連リンク
・2011年 消化器癌シンポジウム abst #362「AVANT:結腸癌術後補助化学療法におけるBevacizumab + XELOX またはBevacizumab + FOLFOX4 vs. FOLFOX4単独の検討 −多施設国際共同無作為化比較第III相試験−」
・2009年 米国臨床腫瘍学会年次集会 abst #LBA4 「Stage II/III結腸癌患者に対する術後補助化学療法mFOLFOX6とmFOLFOX6+bevacizumabを比較した第III相試験結果:NSABP Protocol C-08」
・2010年 米国臨床腫瘍学会年次集会 abst #3508「KRAS 変異型のstage III結腸癌に対する術後補助化学療法としてのmFOLFOX6±cetuximab療法による治療効果の検討:NCCTG intergroup 第III相試験N0147」
・論文紹介「転移を有する大腸癌に対する1st-line治療としてのcetuximab + FOLFOX4のバイオマーカー状態による 有効性 : OPUS試験の成績」
・2011年 米国臨床腫瘍学会年次集会 abst #3510 「切除不能進行・再発大腸癌初回治療例に対するPanitumumab + FOLFOX4療法とFOLFOX4療法の無作為化比較第III相試験 (PRIME試験): 最終報告」
