
Abstract #362
AVANT:結腸癌術後補助化学療法におけるBevacizumab + XELOX またはBevacizumab + FOLFOX4 vs. FOLFOX4単独の検討
−多施設国際共同無作為化比較第III相試験−
AVANT: Results from a randomized, three-arm multinational phase III study to investigate bevacizumab with either XELOX or FOLFOX4 vs. FOLFOX4 alone as adjuvant treatment for colon cancer.
Aimery de Gramont, et al.
|
術後補助化学療法におけるBevacizumabの併用は推奨されない |

|
すでにNSABP C-08試験において補助療法におけるBevacizumabの上乗せ効果は認められなかったが、本試験でも一次エンドポイントである3年DFSにおいて有意差はなく、むしろBevacizumab併用群が化学療法 (FOLFOX) 単独群を下回るという結果となっている。臨床試験としてはネガティブな結果となったことは残念ではあるが、そのなかでも注視すべきはBevacizumabの使用期間と無病生存期間 (disease-free survival: DFS) の累積ハザード比である。治療開始後1年以内はNSABP C-08試験同様に効果が認められたものの、Bevacizumab中止後は前述のように有意差は認められない。この結果より、使用期間が限定される補助化学療法にはBevacizumabは適さないということが読み取れる。術後補助化学療法という治癒を目指す治療において、さらに効果が期待できる治療が確立されなかったことへの落胆は小さいものではないが、現状の標準治療であり副作用のプロファイルも熟知されているFOLFOX療法が、補助化学療法として重要な治療であることを再認識する結果となった。
|
|
| |
 |
Bevacizumabに代表される抗VEGF療法では、腫瘍細胞が休眠状態 (dormant) から悪性度の高い病態へ進行するプロセス (angiogenic switch) における主な役割を担う血管新生因子を抑制することが期待されており、非臨床レベルでの腫瘍縮小効果が示されている。また、臨床においては進行切除不能進行再発大腸癌の治療において、化学療法剤との併用による無増悪生存期間 (progression-free survival: PFS) の延長効果が示されている。
一方、術後補助化学療法では、stage II/III結腸癌に対するmFOLFOX6 ± Bevacizumabの有用性を検討したNSABP C-08試験により、観察期間1年目まではBevacizumab併用の効果が認められたものの、3年DFSではその効果が示されなかったことが報告されている。
今回、我々は結腸癌術後補助化学療法としてのFOLFOX4/XELOX + Bevacizumab vs. FOLFOX4の有用性を検討した国際共同臨床試験AVANTの結果を報告した。
|
 |
対象は、治癒切除後のハイリスクstage IIおよびstage III結腸癌患者とした。試験デザインは下図の通りである。
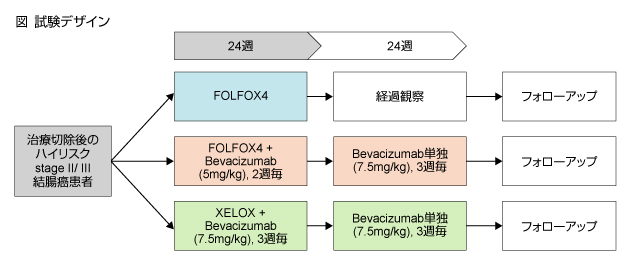
一次エンドポイントは、stage III症例におけるDFS (FOLFOX4単独群との比較)、二次エンドポイントは全生存期間 (overall survival: OS) および安全性とした。
|
 |
|
2004年12月20日から2007年6月8日までに、34ヵ国、330施設からハイリスクstage IIおよびstage III結腸癌患者3,451例が登録された。このうち、stage III症例 2,867例 (FOLFOX4群 955例、FOLFOX4 + Bevacizumab群 960例、XELOX + Bevacizumab群 952例) をITT解析の対象とした。
一次エンドポイントであるstage III症例の3年DFSは、FOLFOX4単独群は76%、FOLFOX4 + Bevacizumab群は73% (HR=1.17, 95% CI: 0.98-1.39)、XELOX + Bevacizumab群では75% (HR=1.07, 95% CI: 0.90-1.28) であり、3群間に差はみられなかった。
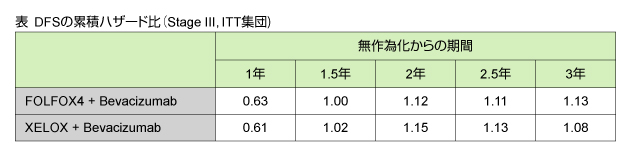
また、FOLFOX4群に対するBevacizumab併用群のDFSの累積ハザード比 (hazard ratio: HR) (表) は、治療開始1年の時点でFOLFOX4 + Bevacizumab群で0.63、XELOX + Bevacizumab群では0.61であったが、治療開始1.5年の時点でBevacizumab併用群がFOLFOX4群を下回り、以降も同様であった。
OSの中間解析は、FOLFOX4群に対するFOLFOX4 + Bevacizumab群およびXELOX + Bevacizumab群のHRは各々1.31、1.27であり、Bevacizumab併用による生存期間の延長は認められなかった。
再発後の転移部位および個数についても、他群間で特に差は認められず、再発後の生存についても、FOLFOX4群に対するFOLFOX4 + Bevacizumab群、XELOX + Bevacizumab群のHRは各々1.23、1.10であり、差はみられなかった。
|
 |
Stage III結腸癌に対する術後補助化学療法においては、Bevacizumabの併用によるDFSの上乗せ効果は認められなかった。
また、本試験におけるBevacizumabの上乗せ効果は一時的なものであり、治療開始1年以内の効果はNSABP C-08試験の結果と一致していたが、その後はBevacizumab併用群がFOLFOX4単独群を下回る結果となり、NSABP C-08試験とは異なっていた。
以上より、BevacizumabはIrinotecan、Cetuximabに続き、切除不能大腸癌に対する有用性は立証されているものの、補助療法としては有用性が認められなかった3番目の薬剤といえる。
|



