
|
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内 で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。 |
切除不能進行・再発大腸癌患者に対する1st-lineとしてのFOLFOX4 + CetuximabにおけるKRAS / NRAS 変異の影響:OPUS試験の新たな解析結果
Effect of KRAS and NRAS Mutations on Treatment Outcomes in Patients with Metastatic Colorectal Cancer (mCRC) Treated First-line with Cetuximab plus FOLFOX4: New Results from the OPUS Study
Sabine Tejpar, et al.

症例数が少なく結論は得られず。CALGB80405試験に期待

OPUS試験は無作為化第II相試験で、FOLFOXに対するCetuximabの上乗せ効果を検討した試験である。CetuximabとL-OHPの組み合わせの第III相試験が2本negativeであったために、その組み合わせの相性が議論を呼ぶなか、OPUS試験での解析に興味が持たれていた。元々の症例数が少ないなかで、さらにminorなRAS の除外を行っているので、一定の傾向はみてとれるものの、PEAK試験やFIRE-3試験でみられたような後半でのOSの開きは見られていない。印象としてはもう少し上乗せがはっきりしてほしかった、というところである。本年の米国臨床腫瘍学会で報告される予定のCALGB80405試験で、FOLFOX + Cetuximabの位置づけが明瞭となることに期待したい。
無作為化第II相試験として実施されたOPUS試験では、KRAS exon 2野生型症例に対し、1st-lineでFOLFOX4 + Cetuximabを投与することで、FOLFOX4単独と比較し、奏効率およびPFSで有意な改善が認められている1)。近年、抗EGFR抗体薬を使用した臨床試験の後解析により、KRAS exon 2野生型であっても他のKRAS またはNRAS 変異例では、優れた有効性が得られないことが示されている2, 3)。そこで、OPUS試験におけるFOLFOX4 + CetuximabのKRAS exon 3, 4、NRAS exon 2, 3, 4変異の有無による有効性、安全性について検証することとした。
OPUS試験に登録されたKRAS exon 2 (codon 12, 13) 野生型症例を対象に、KRAS、NRAS 変異の有無を検討した。KRAS exon 2野生型の85% (179例中152例) で遺伝子変異測定のためのDNA抽出が可能であり、高感度のBEAMing法を用いてKRAS exon 3 (codon 59, 61)、exon 4 (codon 117, 146)、NRAS exon 2 (codon 12, 13)、exon 3 (codon 59, 61)、exon 4 (codon 117, 146) 変異を検査した。
OPUS試験のKRAS exon 2野生型症例の66% (179例中118例) でKRAS 、NRAS 変異が評価され、31% (118例中36例) が何らかのRAS 変異を有していた。KRAS exon 2野生型で他のRAS 変異型はFOLFOX4群29% (65例中19例)、FOLFOX4 + Cetuximab群32% (53例中17例) であり、RAS 変異型 (KRAS exon 2変異を含む何らかのRAS 変異を有する症例) はFOLFOX4群78例、FOLFOX4 + Cetuximab群94例であった。
遺伝子別の変異は、KRAS exon 3: 6.8%、 exon 4: 9.3%、NRAS exon 2: 7.6%、 exon 3: 5.1%、 exon 4: 3.4%であった。
遺伝子別の変異は、KRAS exon 3: 6.8%、 exon 4: 9.3%、NRAS exon 2: 7.6%、 exon 3: 5.1%、 exon 4: 3.4%であった。
既報のKRAS exon 2野生型における解析では、PFS中央値はFOLFOX4群7.2ヵ月、FOLFOX4 + Cetuximab群8.3ヵ月と有意差を認め (HR=0.57, 95% CI: 0.38-0.86, p=0.006)、OS中央値はFOLFOX4群18.5ヵ月、FOLFOX4 + Cetuximab群 22.8ヵ月であり、FOLFOX4 + Cetuximab群で良好な傾向がみられた (HR=0.86, 95% CI: 0.60-1.22, p=0.385) 1)。
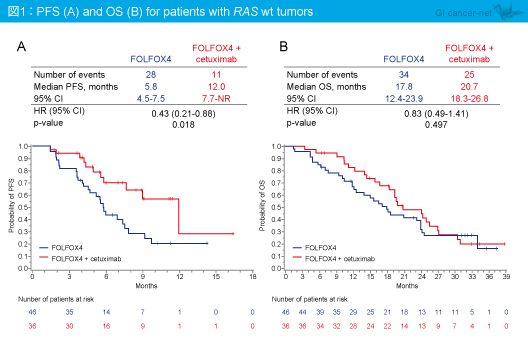
今回の解析において、RAS 野生型 (全てのRAS 遺伝子が野生型) では、PFS中央値はFOLFOX4群5.8ヵ月、FOLFOX4 + Cetuximab群12.0ヵ月と有意差を認め (HR=0.43, 95% CI: 0.21-0.88, p=0.018)、OS中央値はFOLFOX4群17.8ヵ月、FOLFOX4 + Cetuximab群20.7ヵ月であり、有意差は認めなかったもののFOLFOX4 + Cetuximab群で良好な傾向がみられた (HR=0.83, 95% CI: 0.49-1.41, p=0.497) (図1)。
今回の解析において、RAS 野生型 (全てのRAS 遺伝子が野生型) では、PFS中央値はFOLFOX4群5.8ヵ月、FOLFOX4 + Cetuximab群12.0ヵ月と有意差を認め (HR=0.43, 95% CI: 0.21-0.88, p=0.018)、OS中央値はFOLFOX4群17.8ヵ月、FOLFOX4 + Cetuximab群20.7ヵ月であり、有意差は認めなかったもののFOLFOX4 + Cetuximab群で良好な傾向がみられた (HR=0.83, 95% CI: 0.49-1.41, p=0.497) (図1)。
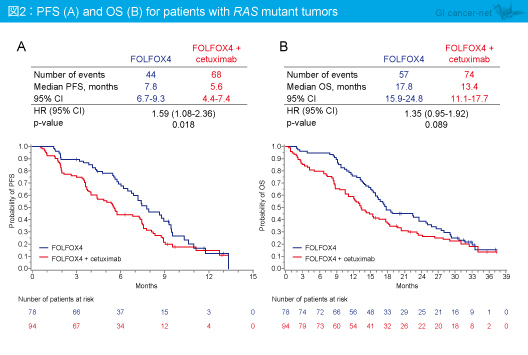
一方、RAS 変異型では、PFS中央値はFOLFOX4群7.8ヵ月、FOLFOX4 + Cetuximab群5.6ヵ月 (HR=1.59, 95% CI: 1.08-2.36, p=0.018)、OS中央値はそれぞれ17.8ヵ月、13.4ヵ月であり (HR=1.35, 95% CI: 0.95-1.92, p=0.089)、FOLFOX4 + Cetuximab群で短縮する傾向がみられた (図2)。また、KRAS exon 2野生型で他のRAS 変異型では、PFSは両群で類似しており (中央値7.4ヵ月 vs. 7.3ヵ月, HR=1.02, 95% CI: 0.41-2.55, p=0.961)、OS (中央値17.8ヵ月 vs. 14.8ヵ月, HR=1.41, 95% CI: 0.62-3.21, p=0.409) はFOLFOX4 + Cetuximab群で不良な傾向がみられた。
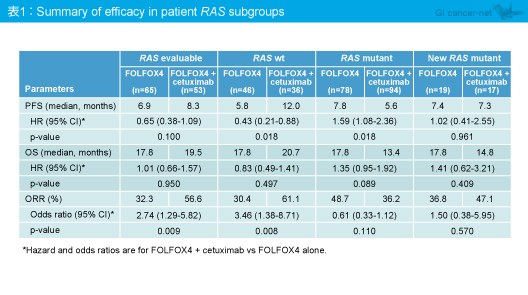
奏効率も同様に、RAS 野生型ではFOLFOX4 + Cetuximab群が有意に良好で (OR=3.46, 95% CI: 1.38-8.71, p=0.008)、RAS 変異型ではFOLFOX4 + Cetuximab群が不良な傾向がみられたが (OR=0.61, 95% CI: 0.33-1.12, p=0.110)、KRAS exon 2野生型で他のRAS 変異型ではFOLFOX4 + Cetuximab群で良好な傾向がみられた (OR=1.50, 95% CI: 0.38-5.95, p=0.570) (表1)。
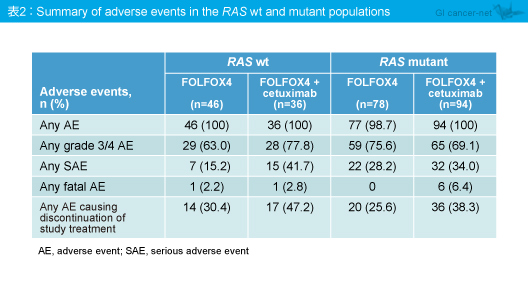
有害事象の発現頻度は、RAS 野生型とRAS 変異型で類似していた (表2)。Grade 3/4の有害事象および重篤な有害事象、治療中止につながる有害事象に関しては、RAS 野生型のFOLFOX4 + Cetuximab群で僅かに多くみられたが、サンプルサイズが小さいサブグループのデータであったためと考えられた。
KRAS またはNRAS に変異を有する切除不能進行・再発大腸癌に対して、FOLFOX4にCetuximabを併用することによるベネフィットは認められないが、RAS 変異型を除外することで、FOLFOX4 + Cetuximabのリスク・ベネフィットプロファイルは改善される。
新たなRAS 変異における今回の解析は、症例数が少ないため明確な結論は得られないが、FOLFOX4 + Cetuximabの投与をRAS 野生型に限定することで、最大限の患者ベネフィットがもたらされることが期待される。
新たなRAS 変異における今回の解析は、症例数が少ないため明確な結論は得られないが、FOLFOX4 + Cetuximabの投与をRAS 野生型に限定することで、最大限の患者ベネフィットがもたらされることが期待される。
