
|
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内 で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。 |
EXPERT-C試験におけるRAS 解析:高リスク直腸癌に対する術前化学放射線療法としてのCapecitabine + L-OHP + 放射線療法 ± Cetuximabの無作為化第II相試験
RAS Mutations in EXPERT-C, a Randomized Phase II Trial of Neoadjuvant Capecitabine and Oxaliplatin and Chemoradiotherapy with or without Cetuximab in High-risk Rectal Cancer
Francesco Sclafani, et al.

EXPERT-C試験においてRAS野生型でのCetuximabの有用性は示せず。

新たなRAS 変異はKRAS exon 2野生型の約13%に指摘され、他の試験での変異型の割合と同様であった。新たなRAS も含めたRAS 野生型はCAPOX群40例、CAPOX-C群38例となった。これらの症例で比較された結果は、術前補助化学療法で有意差を認めたが、pCR率、PFS、OSともに有意差を見いだせなかった。全てのRAS 変異を除くことで、有効症例の割合を増やし、効果を確認したかったところだが、今回の検討ではその上乗せ効果を示せなかった。ただし、PFSとOSのKaplan-Meier曲線を見ると、CAPOX-C群が上にあり、演者の見解のように症例数が少なくなったために有意差を示せなかった可能性も考えられ、大規模な臨床試験での検証が必要と考えられた。
KRAS exon 2, 3およびBRAF 野生型の大腸癌において、進行・再発癌とは対照的に補助化学療法における抗EGFR抗体薬のベネフィットは示されていない2, 3)。近年、進行・再発大腸癌においては、KRAS exon 2以外のRAS (KRAS exon 3, 4、NRAS exon 2, 3, 4) も検査することで抗EGFR抗体薬のベネフィットを予測し、有効性を最大化することが認められている4, 5)。しかし、全RAS 解析を行うことで、補助化学療法においても進行・再発癌と同様の効果を得られるかは不明である。また、BRAF 変異は抗EGFR抗体薬の負の効果予測よりも予後不良因子であることが知られている6, 7)。
EXPERT-C試験では、KRAS exon 2, 3/BRAF 野生型の高リスク直腸癌に対する術前化学放射線療法および術後補助化学療法に対してCetuximabを上乗せしても、CR率、PFS1)、OS2) に有意な改善が認められないことが報告されている。今回、EXPERT-C試験においてRAS 変異が治療効果に及ぼす影響について解析した。
EXPERT-C試験では、KRAS exon 2, 3/BRAF 野生型の高リスク直腸癌に対する術前化学放射線療法および術後補助化学療法に対してCetuximabを上乗せしても、CR率、PFS1)、OS2) に有意な改善が認められないことが報告されている。今回、EXPERT-C試験においてRAS 変異が治療効果に及ぼす影響について解析した。
EXPERT-C試験の対象は、18歳以上、WHO PS 0-2で、MRI所見で高リスクと判定された切除可能な直腸癌患者であった。術前化学療法 (Capecitabine + L-OHP: CAPOX) 後に化学放射線療法 (Capecitabine + 放射線療法) を行い、全直腸間膜切除術 (TME) 後に術後補助化学療法 (CAPOX) を施行する群 (CAPOX群) と、術前化学療法、化学放射線療法、術後補助化学療法にそれぞれCetuximabを上乗せする群 (CAPOX-C群) とに1:1で割り付けられた (図1)。
KRAS exon 2, 3およびBRAF exon 15変異についてはINFINITI platformで、NRAS exon 3変異についてはmultiplex PCRにより既に解析されており、今回、KRAS exon 4およびNRAS exon 2, 4変異について、双方向性のサンガー法によるDNAシークエンスにより後ろ向きに解析された。
KRAS exon 2, 3およびBRAF exon 15変異についてはINFINITI platformで、NRAS exon 3変異についてはmultiplex PCRにより既に解析されており、今回、KRAS exon 4およびNRAS exon 2, 4変異について、双方向性のサンガー法によるDNAシークエンスにより後ろ向きに解析された。
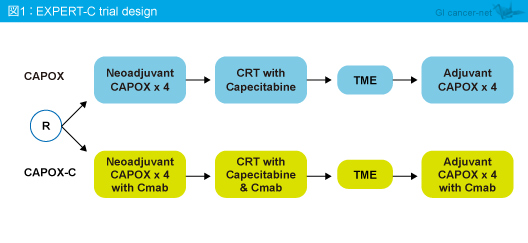
EXPERT-C試験で評価が可能であった149例中59例 (39.6%) にKRAS exon 2, 3/BRAF 変異が認められ、KRAS exon 2, 3/BRAF 野生型90例中4例 (4.4%) にNRAS exon 3変異が認められた。
KRAS exon 2, 3/NRAS exon 3/BRAF 野生型86例中84例 (97.7%) で、今回新たにKRAS exon 4、NRAS exon 2,4変異が解析され、11例 (13.1%) に新たなRAS 変異が認められた (KRAS exon 4変異型9例、NRAS exon 2変異型2例) (表1)。
KRAS exon 2, 3/NRAS exon 3/BRAF 野生型86例中84例 (97.7%) で、今回新たにKRAS exon 4、NRAS exon 2,4変異が解析され、11例 (13.1%) に新たなRAS 変異が認められた (KRAS exon 4変異型9例、NRAS exon 2変異型2例) (表1)。
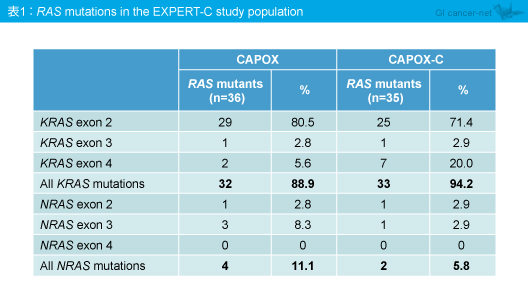
全てのRAS に変異を有さないRAS 野生型は、149例中78例 (52.3%) (CAPOX群40例、CAPOX-C群38例) であり、患者背景は両群間でバランスがとれていた。
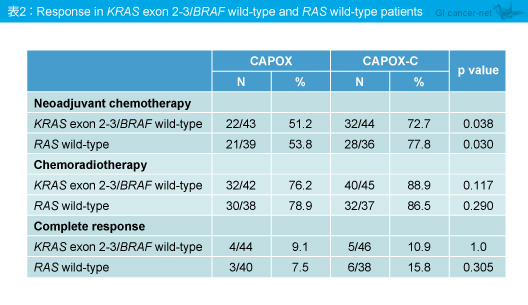
RAS 野生型における術前補助化学療法の奏効率は、CAPOX群53.8%、CAPOX-C群77.8%とCAPOX-C群で有意に優れていたものの (p=0.030)、化学放射線療法の奏効率 (p=0.290) やCR率 (p=0.305) は有意差を認めなかった (表2)。
RAS 野生型における術前補助化学療法の奏効率は、CAPOX群53.8%、CAPOX-C群77.8%とCAPOX-C群で有意に優れていたものの (p=0.030)、化学放射線療法の奏効率 (p=0.290) やCR率 (p=0.305) は有意差を認めなかった (表2)。
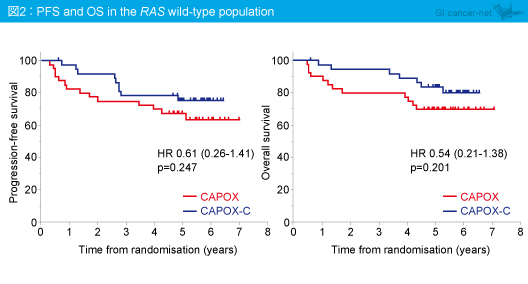
RAS 野生型における5年PFSは、CAPOX群67.5%、CAPOX-C群75.5%であり、有意差を認めなかった (HR=0.61, 95% CI: 026-1.41, p=0.247) (図2)。また、5年OSに関しても、それぞれ70.0%、83.8%であり、有意差を認めなかった (HR=0.54, 95% CI: 0.21-1.38, p=0.201)。
なお、149例中4例 (2.7%) にBRAF 変異を認め、そのうち1例は同時にKRAS G12D変異も認めたが、RAS /BRAF 野生型におけるCetuximabの上乗せ効果は、RAS 野生型と比べ有意差は認められなかった。
なお、149例中4例 (2.7%) にBRAF 変異を認め、そのうち1例は同時にKRAS G12D変異も認めたが、RAS /BRAF 野生型におけるCetuximabの上乗せ効果は、RAS 野生型と比べ有意差は認められなかった。
高リスク局所進行直腸癌におけるRAS 検査は、Cetuximabの症例選択に有用ではなかったが、本試験は後ろ向きの解析であり、症例数が少ないことも原因と考えられる。早期大腸癌に対する抗EGFR抗体薬の効果に及ぼすRAS 変異の影響については、今後、より大規模な試験で検証する必要がある。
Reference
1) Dewdney A, et al.: J Clin Oncol. 30(14): 1620-1627, 2012[PubMed]
2) Sclafani F, et al.: ESMO2013: abst #2168[学会レポート]
3) Alberts SR, et al.: JAMA. 307(13): 1383-1393, 2012[PubMed]
4) Douillard JY, et al.: N Engl J Med. 369(11): 1023-1034, 2013[PubMed]
5) Heinemann V, et al.: ESMO2013: abst #LBA17[学会レポート]
6) Tol J, et al.: N Engl J Med. 361(1): 98-99, 2009[PubMed]
7) Van Cutsem E, et al.: J Clin Oncol. 29(15): 2011-2019, 2011[PubMed]
1) Dewdney A, et al.: J Clin Oncol. 30(14): 1620-1627, 2012[PubMed]
2) Sclafani F, et al.: ESMO2013: abst #2168[学会レポート]
3) Alberts SR, et al.: JAMA. 307(13): 1383-1393, 2012[PubMed]
4) Douillard JY, et al.: N Engl J Med. 369(11): 1023-1034, 2013[PubMed]
5) Heinemann V, et al.: ESMO2013: abst #LBA17[学会レポート]
6) Tol J, et al.: N Engl J Med. 361(1): 98-99, 2009[PubMed]
7) Van Cutsem E, et al.: J Clin Oncol. 29(15): 2011-2019, 2011[PubMed]
