|
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内 で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。 |

アジア人におけるHER2陽性進行胃癌に対する2nd-line治療としてのweekly Paclitaxel ± Lapatinibのオープンラベル無作為化第III相試験:TyTAN試験
A Randomized, Open-label, Phase III Study of Lapatinib in Combination with Weekly Paclitaxel versus Weekly Paclitaxel Alone in the Second-line Treatment of HER2 Amplified Advanced Gastric Cancer (AGC) in Asian Populations: TyTAN study.
Yung-Jue Bang, et al.

TyTAN試験でまた1つ学んだ胃癌における分子標的薬開発の難しさ
〜グローバル開発においていよいよ窮地に立たされた日本の行く末〜
〜グローバル開発においていよいよ窮地に立たされた日本の行く末〜

さてTyTAN試験。Trastuzumabで抗HER2療法の可能性が開けたことから、本試験では今までの試験以上にpositiveな結果が期待されていた。結果、OS、PFS (progression-free survival) でも優越性が検証できない結果に終わった。勿論、HER2の定義に問題はあったろう。IHC優先にしていればこの結果は回避できたかもしれない。分子標的治療薬において至適なバイオマーカーを用いて適正にenrichmentを図ることが重要な鍵を握るという教訓は恐らく正しい。ただ、日本のPFSがL + P群3.7ヵ月、P群4.0ヵ月に対して、日本以外 (中国、韓国、台湾) ではL + P群6.2ヵ月、P群4.6ヵ月であり、日本のOS中央値がL + P群12.0ヵ月、P群14.6ヵ月に対して、日本以外ではL + P群10.6ヵ月、P群8.1ヵ月であった。上述の非難も納得せざるを得ない、大いなる相違である。何故こういう結果になったのか、そして、今後の日本のグローバル開発の参加の仕方をわれわれ自身で真剣に検討しなくてはいけない時期に来ている。もはや待ったなしの状況である。
TrastuzumabはHER2陽性進行胃癌の標準的な1st-line治療として確立されている。一方、HER2陽性進行胃癌の2nd-line治療におけるHER2阻害薬の役割は明確にされておらず、アジア諸国においてはweekly Paclitaxel (wPTX) が2nd-line治療として広く用いられている。Lapatinib (LAP) は、上皮成長因子受容体 (EGFR) とHER2のチロシンキナーゼを阻害する新たなHER2阻害薬である。
TyTAN試験は、HER2陽性進行胃癌に対する2nd-line治療としてのwPTXに対するLAPの上乗せ効果を検討する初の無作為化比較試験である。
TyTAN試験は、HER2陽性進行胃癌に対する2nd-line治療としてのwPTXに対するLAPの上乗せ効果を検討する初の無作為化比較試験である。
対象はFISH法によりHER2遺伝子の増幅が確認された20歳以上の進行胃癌患者であり、フッ化ピリミジン系薬剤and/or Cisplatinによるレジメンを1つ施行されたECOG PS 0/1の症例について、LAP 1,500mg (daily) + wPTX 80mg/m2 (day1, 8, 15を4週毎) を投与する群 (L + P群) と、wPTX 80mg/m2 (day1, 8, 15を4週毎) のみを投与する群 (P群) とに無作為に割り付けられた (図1) 。
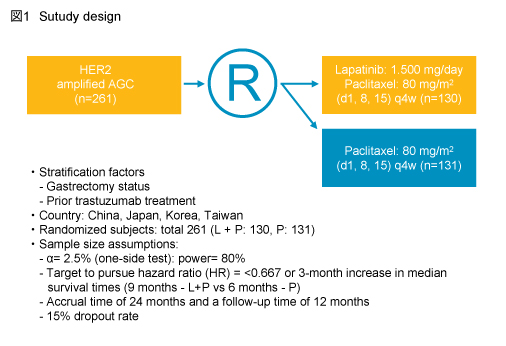
主要評価項目はOSであり、260例のサンプルサイズが必要であった。また、副次評価項目は独立評価委員会判定によるPFS、奏効率、安全性、QOLであった。
2008年3月〜2011年6月までに1,924例 (日本人498例) がスクリーニングされ、HER2陽性患者430例 (22.3%) のうち261例 (日本人100例) が、L + P群132例、P群129例に無作為に割り付けられた。患者背景は両群間でよくバランスがとれていた。
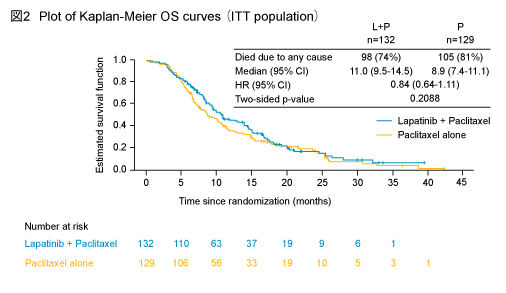
主要評価項目であるOSの中央値はL + P群11.0ヵ月、P群8.9ヵ月であり、両群間に有意な差は認められなかった (HR=0.84, 95% CI: 0.64-1.11, p=0.2088) (図2) 。
主要評価項目であるOSの中央値はL + P群11.0ヵ月、P群8.9ヵ月であり、両群間に有意な差は認められなかった (HR=0.84, 95% CI: 0.64-1.11, p=0.2088) (図2) 。
また、PFS中央値はL + P群5.4ヵ月、P群4.4ヵ月であり、2群間に有意差は認められなかった (HR=0.85, 95% CI: 0.63-1.13, p=0.2441) 。奏効率はそれぞれ27%、9%であった。
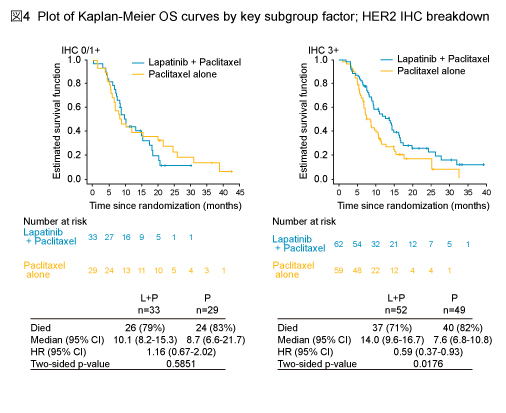
なお、事前に計画されたサブグループにおける解析も同時に行われた (図3) 。免疫組織化学染色 (IHC) によるHER2判定を用いて解析したところ、IHC3+ 症例のOS中央値はL + P群14.0ヵ月、P群7.6ヵ月と、L + P群で有意な延長を認めたが (HR=0.59, 95% CI: 0.37-0.93, p=0.0176) 、IHC 0/1+ 症例では有意差を認めなかった (HR=1.16, 95% CI: 0.67-2.02, p=0.5851) (図4) 。同様に、IHC3+ 症例のPFS中央値は、L + P群5.6ヵ月、P群4.2ヵ月と、L + P群で有意な延長を認めた (HR=0.54, 95% CI: 0.33-0.90, p=0.0101) 。
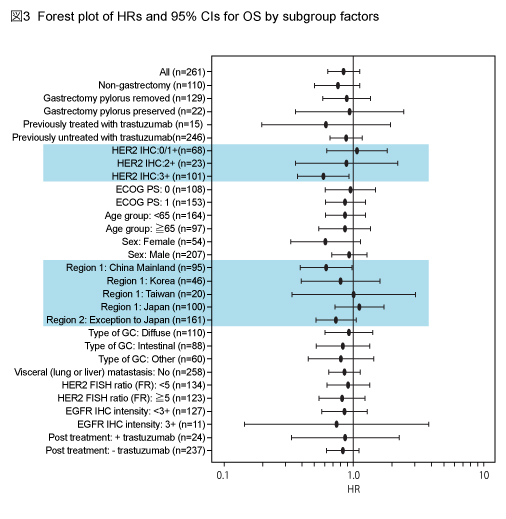
地域別のサブグループ解析では、日本人のOS中央値はL + P群12.0ヵ月、P群14.6ヵ月とL + P群が下回り (HR=1.09, 95% CI=0.71-1.69, p=0.6713) 、PFS中央値もL + P群3.7ヵ月、P群4.0ヵ月であった (HR=1.09, 95% CI: 0.70-1.72, p=0.6888) 。
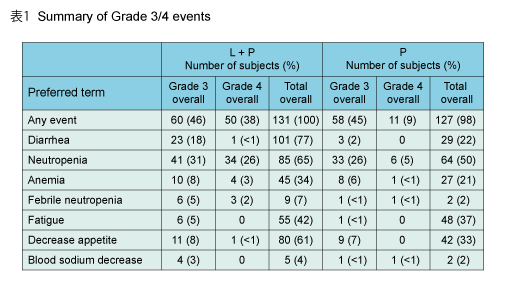
全体的な安全性プロファイルは、乳癌を対象にwPTX ± LAPを検討したEGF104535試験の結果と一致しており、予想外の新たな毒性の発現は認めなかった。有害事象の多くがgrade 1/2であり、grade 3/4の有害事象はLAPとPTXの確立された安全性プロファイルと全般に一致していた (表) 。なお、有害事象を経験したL + P群の患者の多くが、PD後の後治療にも忍容性を示した。
全体的な安全性プロファイルは、乳癌を対象にwPTX ± LAPを検討したEGF104535試験の結果と一致しており、予想外の新たな毒性の発現は認めなかった。有害事象の多くがgrade 1/2であり、grade 3/4の有害事象はLAPとPTXの確立された安全性プロファイルと全般に一致していた (表) 。なお、有害事象を経験したL + P群の患者の多くが、PD後の後治療にも忍容性を示した。
主要評価項目のOSは有意な差を認めなかったが、OS中央値はL + P群がP群よりも約2ヵ月の延長を示した。また、IHC3+ のサブグループでは、LAPを追加することでOSおよびPFSの双方で有意な延長が認められた。
この試験がnegativeに終わった大きな原因の1つは、IHC 0/1+ 症例が35%と予期せぬほど高率だったためと考えられる (ToGA試験のIHC 0/1+ 症例 23%1)) 。 なお、L + P群の安全性プロファイルは乳癌を対象としたLAP関連の臨床試験と一致しており、新たな毒性の発現はみられなかった。
この試験がnegativeに終わった大きな原因の1つは、IHC 0/1+ 症例が35%と予期せぬほど高率だったためと考えられる (ToGA試験のIHC 0/1+ 症例 23%1)) 。 なお、L + P群の安全性プロファイルは乳癌を対象としたLAP関連の臨床試験と一致しており、新たな毒性の発現はみられなかった。
