背景と目的
ヒアルロン酸 (hyaluronan: HA) は、腫瘍内圧の上昇、血管の圧迫、間質の線維化などにより化学療法の灌流を阻害し、効果を減弱させることが知られており、免疫細胞の接近を阻害することも示されている1,2)。膵癌においては、細胞外マトリックスにHAが豊富に存在し、このことが化学療法の効果を減弱させ、予後不良となる一因であると考えられている。
PEGylated recombinant human hyaluronidase (PEGPH20) はHAを除去する酵素であり、HAが除去されることにより腫瘍内圧の低下、血管の再拡張の誘導がもたらされる。その結果、化学療法の腫瘍内濃度の上昇や腫瘍増殖、転移の抑制がもたらされることが、膵癌細胞株を用いたxenograft modelにおいて示されている1,2)。また、Gemcitabineと併用した第Ib相試験においては、HA高値の膵癌症例 (HA-high) は、HA低値の症例 (HA-low) と比較し奏効率 (67% vs. 27%)、PFS (中央値219日 vs. 108日)、OS (中央値395日 vs. 174日) が良好であった3)。
今回、現在行われているnab-Paclitaxel + Gemcitabine + PEGPH20の第II相試験の中間解析の結果が発表された。
対象と方法
対象は、stage IVの膵管癌患者260例であり、nab-Paclitaxel + Gemcitabine + PEGPH20 (PAG) 群とnab-Paclitaxel + Gemcitabine (AG) 群に無作為に割り付けられた。
主要評価項目はPFSと血栓塞栓症 (thromboembolic events: TEs) の割合、副次評価項目はHA levelごとのPFS、奏効率、安全性であった。
結果
2013年3月~2014年4月の間に146症例が登録された時点で、TEsの割合がPAG群28.4%、AG群14.8%とPAG群で高値であったためclinical holdとなり、それまでに登録された症例がstage 1として解析された。また、プロトコール変更が行われ、TEsリスクが高い症例は除外すること、低分子ヘパリンを併用することでstage 2が現在進行中である。今回は、stage 1の効果と安全性が報告された。
奏効率は、全体ではPAG群41%、AG群34%であり有意差を認めなかったが (p=0.48)、HA-highではPAG群52%、AG群24%であり、PAG群で有意に良好であった (p=0.038) (表1)。また、HA-highにおける効果の持続 (duration of response: DoR) はPAG群 8.1ヵ月、AG群3.7ヵ月であり、PAG群でより長く効果が持続した。
表1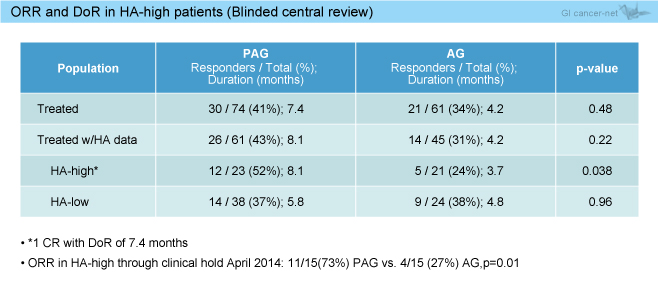
PFS中央値は、全体ではPAG群5.7ヵ月、AG群5.2ヵ月と差を認めなかったが (p=0.11)、HA-highではPAG群9.2ヵ月、AG群4.3ヵ月でありPAG群で良好な結果であった (p=0.05) (図1)。
図1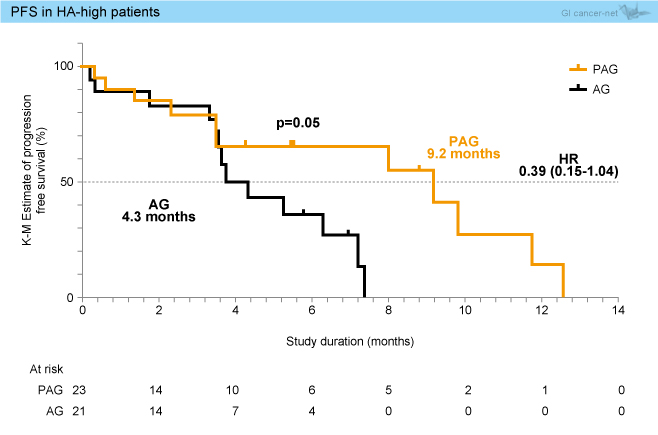
OSはHA-highにおいても有意差を認めなかったものの、PAG群12ヵ月、AG群9ヵ月であり、PAG群で良好な傾向がみられた (HR=0.62, 95% CI: 0.26-1.46) (図2)。
図2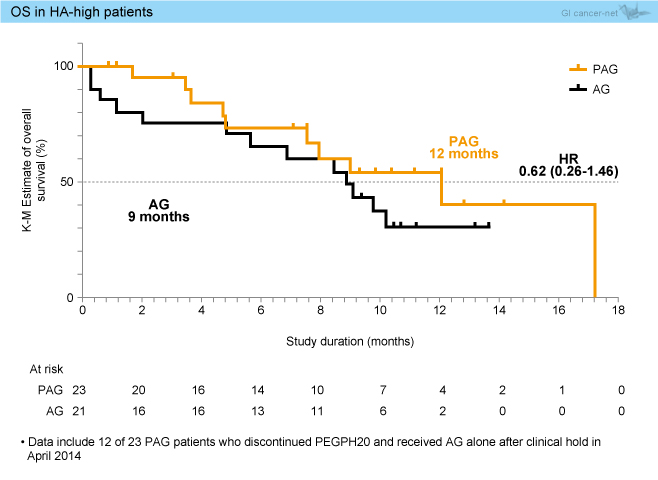
有害事象は、倦怠感 (PAG群67.6% vs. AG群68.9%)、悪心 (55.4% vs. 44.3%)、貧血 (41.9% vs. 52.5%)、末梢浮腫 (58.1% vs. 31.1%)、筋肉痙攣 (55.4% vs. 1.6%)、好中球減少 (32.4% vs. 18.0%) などがみられた。
なお、TEsについては低分子ヘパリンを併用したstage 2ではPAG群13%、AG群18%と両群に差を認めなかった。
結論
PEGPH20をnab-Paclitaxel + Gemcitabineに併用することで、HA-highの進行再発膵癌に対して有意に良好な奏効率を示し、PFS、DoR、OSも良好な傾向にあった。また、TEsは低分子ヘパリンを併用することで制御可能であった。なお、PAG群とAG群を比較するプラセボ対照二重盲検第III相試験が2016年から開始される予定である。
コメント
膵管腺癌 (PDAC) では、原発巣と転移巣の細胞外マトリックスの量が予後と負の相関を示すことが報告されており4)、HA高値例の予後は低値例と比較して有意に不良であるという。また、HA合成酵素の活性高値やHAの分解酵素の活性低値は、いずれもPDACの予後不良因子と報告されている5)。その機序の一つは、上記の「背景と目的」で述べられているとおりである。そのHAを腫瘍の微小環境 (TME) から除去し、薬剤感受性を高めようとする新たな治療法の報告である。原発巣や転移巣内のHA量が効果予測因子と考えられているが、その定量には免疫組織学的検索が必要である。ただ、切除不能膵癌原発巣の組織採取には大きな危険を伴うため、膵癌組織内のHAを定量する方法、あるいはHA量と相関するバイオマーカーの開発が望ましい。
今後行われる第III相試験の結果で有効性が確認されれば、PEGPH20とFOLFIRINOXなど他の化学療法剤との併用効果も期待できる。さらに、今回の米国臨床腫瘍学会年次集会で非常に話題になっている免疫チェックポイント阻害剤との併用など、膵癌の治療戦略に大きなインパクトを与える可能性があると考えられる。
(レポーター:中村 将人 監修・コメント:大村 健二)
- Reference
-
- 1) Jacobetz MA, et al.: Gut. 62(1): 112-120, 2013[PubMed]
- 2) Kultti A, et al.: Biomed Res Int. 817613, 2014[PubMed]
- 3) Sunil R, et al.: 2015 Gastrointestinal Cancers Symposium. abst #359
- 4) Whatcott CJ, et al.: Clin Cancer Res. 2014 [Epub ahead of print][PubMed]
- 5) Cheng XB, et al.: PLoS One. 8(11): e80765, 2013[PubMed]


