![]()
Abstract #3516
FOLFOX + Cetuximab療法の効果予測因子としてのEpiregulin (EREG) / Amphiregulin (AREG) の遺伝子発現:MRC COIN試験のデータより
Epiregulin (EREG) and Amphiregulin (AREG) gene expression predict response to cetuximab (cet) therapy in combination with oxaliplatin (Ox) and 5FU in first-line treatment of advanced colorectal cancer (aCRC) - Results from the MRC COIN trial.
対象と方法
対象はMRC COIN試験1)のA群 (FOLFOX / XELOX療法) およびB群 (FOLFOX / XELOX + Cetuximab療法) に登録された症例とした。原発巣のホルマリン固定パラフィン包埋標本を用い、EGFR免疫染色ならびにRT-PCR法によって、KRAS / NRAS / BRAF 遺伝子変異の有無とEREG / AREGの遺伝子発現の程度を解析した。
EREG / AREG発現と患者背景の相関はピアソンの積率相関係数を用いて解析した。また、KRAS statusとFluoropyrimidineの種類 (Capecitabine [XELOX] ; 5-FU [FOLFOX]) により効果予測因子解析を行った。交互作用に関する検定はflexible parametric survival analysisを用いた。
結果
全パラメーター1,630例中952例 (57%) で評価された。EREG / AREG高発現と相関を示したのは、KRAS 野生型、BRAF 変異型、MSI present、直腸、左側結腸、肝転移あり、腹膜転移あり、原発巣非切除、無作為割付け後の根治手術、ALP / CEA高値であった。また、Cetuximab併用の有無にかかわらずKRAS 遺伝子変異とEREG発現の程度別にOS (overall survival) とPFS (progression-free survival) を解析したところ、いずれもEREG高発現かつKRAS 野生型症例で有意な改善が認められた (図1)。
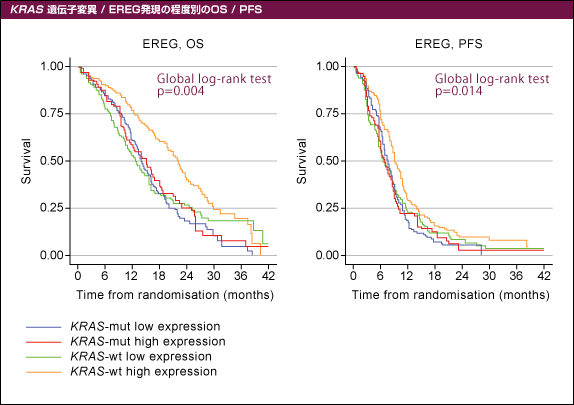
図1
効果予測因子としての検討では、EREG高発現はKRAS 野生型症例におけるCetuximabの上乗せ効果の予測因子であり (p=0.017)、特にFOLFOX群で顕著であった (p=0.0042) (図2)。一方、XELOXを施行された群ではEREG低発現がCetuximabの上乗せ効果の予測因子と考えられたが、統計学的有意差は得られなかった。
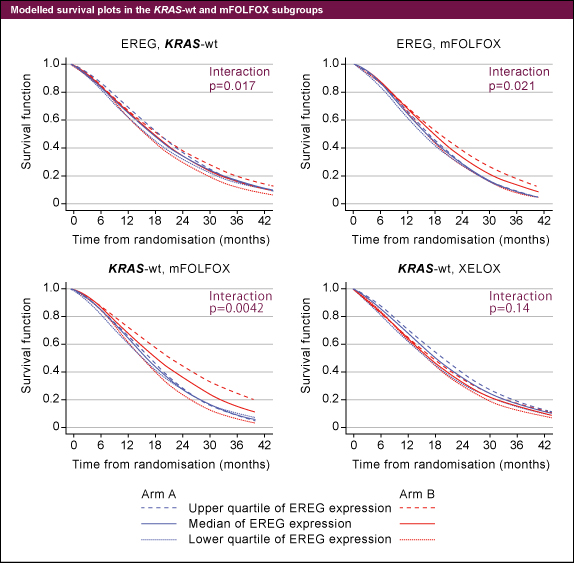
図2
結論
本解析より、KRAS 野生型でかつEREG高発現であることがCetuximabの使用にかかわらず、予後良好な患者群であることが示唆された。また、EREG高発現はKRAS 野生型の症例において一次治療としてのFOLFOXへのCetuximabの上乗せ効果を予測したが、XELOXでは効果予測因子となり得なかった。
![]()
Abstract #3519
XELIRI / XELOX + Cetuximab療法を施行されたKRAS 野生型切除不能大腸癌患者における効果予測因子としてのEGFR遺伝子増幅ならびにAREG / EREG発現 : AIO CRC-0104試験の解析
Ligand expression of the EGFR ligands amphiregulin, epiregulin, and amplification of the EGFR gene to predict for treatment efficacy in KRAS wild-type mCRC patients treated with cetuximab plus CAPIRI and CAPOX: Analysis of the randomized AIO CRC-0104 trial.
背景
AIO CRC-0104試験は化学療法未施行の大腸癌を対象として、XELIRI + Cetuximab療法およびXELOX + Cetuximab療法を比較した無作為化比較第II相試験である。本試験はKRAS statusに関係なく登録され、全症例の解析ではKRAS 遺伝子変異は治療効果との相関を示さなかった2)。
対象と方法
対象は本試験に登録された大腸癌患者185例。FISH法を用いてEGFR遺伝子増幅を、RT-qPCR法を用いてAREG / EREGの発現レベルを検索し、治療効果との関連性を検証するために、奏効率、PFS、OSとの相関を検討した。EGFR遺伝子増幅ならびにAREG / EREG発現レベルのcut-off値は奏効率に対するROC (receiver operating characteristic) 解析を用いて算出した。
結果
KRAS 野生型のサブグループにおける99例の腫瘍検体を用いて解析を行った。AREG高発現例では有意に奏効率 (83% vs. 46%, p=0.006, OR=0.31)、PFS (8.4ヵ月 vs. 4.9ヵ月, p<0.001, HR=0.35)、OS (39.9ヵ月 vs. 17.1ヵ月, p<0.001, HR=0.36) が良好であった (表1、図3)。また、EREG高発現例では有意に奏効率 (74% vs. 46%, p=0.036, OR=0.54)、PFS (7.9ヵ月 vs. 4.9ヵ月, p=0.026, HR=0.58) ならびにOS (33.0ヵ月 vs. 20.2ヵ月, p=0.041, HR=0.57) が良好であった。
さらに、EGFR遺伝子増幅例でも有意に奏効率 (71% vs. 33%, p=0.004, OR=0.49)、PFS (8.4ヵ月 vs. 4.6ヵ月, p=0.004, HR=0.49) ならびにOS (30.5ヵ月 vs. 15.2ヵ月, p=0.001, HR=0.44) が良好であった。
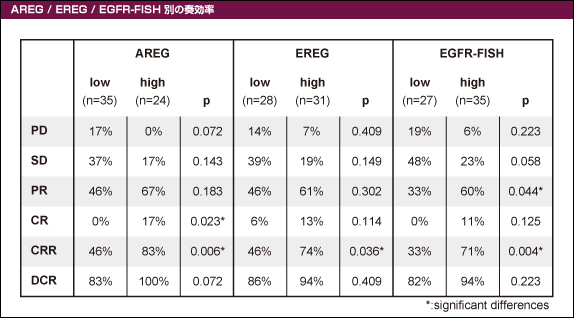
表1
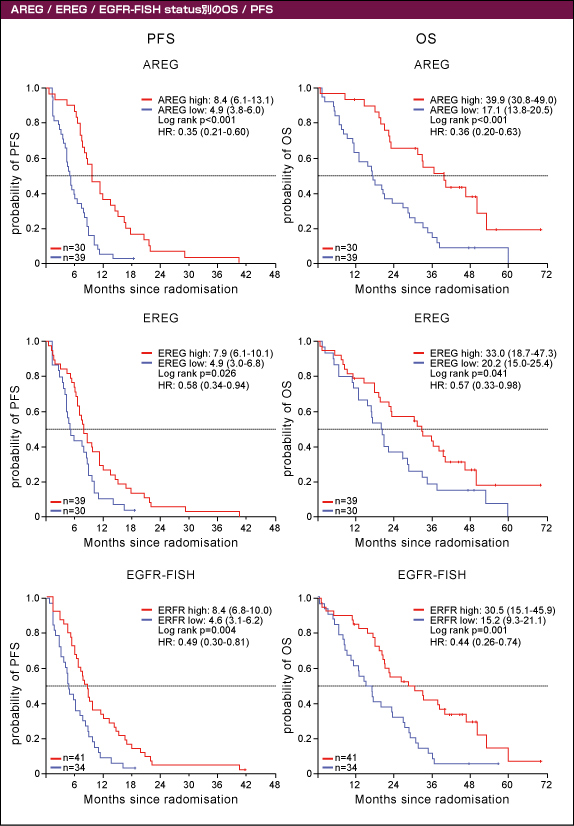
図3
結論
一次治療としてのXELIRI / XELOX + Cetuximab療法において、AREG / EREGの発現レベルならびにEGFR遺伝子増幅は治療効果を予測した。また、KRAS 野生型症例において、EGFR遺伝子増幅ならびにAREG発現は治療効果との極めて強い相関を示した。
コメント
EGFRのリガンドであるEREG / AREGの発現がKRAS 野生型の症例において、抗EGFR抗体薬の治療効果予測に有用であることはこれまでもいくつか報告されている。今回、さらに英MRCと独AIOの2つのグループから報告がなされた。
COIN試験ではEREG発現が予後因子となっており、AIO CRC-0104試験ではEREG / AREGともに強い効果予測因子であるなど、2つの試験結果は微妙に異なるものの、これらリガンドの発現により治療効果が予測可能であることが示唆された。ただし、COIN試験での治療効果の差はminimalであり、AIO CRC-0104試験でcut-off値算出の根拠となったROCのAUC (area under curve) はかなり低値である。これら分子の発現に基づいた前向きの臨床試験を企画する前に、測定方法の確立を含めたさらなる validationが必要と思われる。
(レポート:結城 敏志、監修・コメント:寺島 雅典)
- Reference
- 関連リンク


