2008年の米国臨床腫瘍学会年次集会では、CRYSRTAL試験などの大規模臨床試験におけるKRAS statusの解析結果が報告され、話題を独占した(2008年 米国臨床腫瘍学会年次集会 Abstract #LBA2)。 6月1日のPoster Discussionでは、KRASと新バイオマーカーに関する3演題が報告され、注目を集めた。
Derek J. Jonker氏(Ottawa Hospital, Canada)は、KRAS野生型の大腸癌(CRC)患者における、cetuximabの効果予測因子としてのepiregulin (EREG)発現レベルについて、Hans Prenen氏(Katholieke Universiteit Leuven, Belgium)は、cetuximabで治療した転移性大腸癌(mCRC)の予後予測におけるamphiregulin(AREG)とepiregulinの発現について報告した。また、Fotios Loupakis氏(Azienda Ospedaliera-Universitaria Pisano, Italy)は、KRAS野生型のCRC患者におけるcetuximab+CPT-11療法の効果予測因子としてのAREG発現について報告した。
Abstract #4016 |
進行性大腸癌におけるcetuximabの効果予測因子としてのepiregulin遺伝子発現レベルとKRAS野生型: 第III相試験NCIC CTG CO.17の結果より |
High epiregulin gene expression plus K-ras wild-type status as predict for cetuximab benefit in the treatment of advanced colorectal cancer -results from NCIC CTG CO.17: A phase III trial of cetuximab vs. best supportive care. |
|
NCIC CTG CO.17試験は、進行再発大腸癌患者におけるbest supportive care(BSC)±cetuximabを比較・検討した第III相試験である(Jonker DJ, et al.: NEJM. 357(20),
2007)。KRAS変異のある症例では、cetuximabの治療効果が期待できないことが報告されている(Karapetis C, et al.: NEJM. 359(17), 2008)。
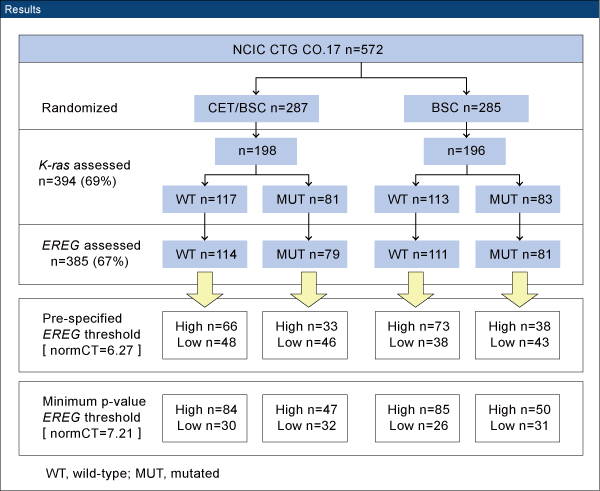
対象は治療抵抗性のEGFR陽性mCRC患者572例であり、cetuximab+BSC群(287例)またはBSC単独群(285例)に無作為割り付けされた。今回の解析では、KRAS statusは394例(69%)、epiregulin(EREG)は385例(67%)について評価を行った。
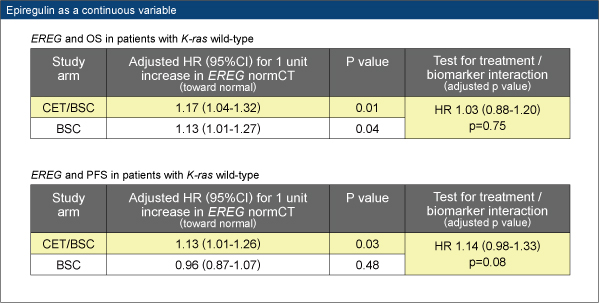
KRAS野生型でEREG発現が低い場合は、両群ともにOSが不良であり、cetuximab群ではPFSも不良であった。
以前の報告で設定したcut-off値によるEREG発現レベルで評価すると、EREG高発現KRAS野生型患者は139例(36%)に認められた。一方、今回の結果から最もp値が小さくなるように計算されたcut-off値に基づく閾値で評価すると、169例(44%)に認められた。
EREG高発現KRAS野生型患者について、cetuximab+BSC群とBSC単独群とを比較した結果、奏効率はそれぞれ16.7%と0%、PFS中央値は5.4ヵ月と1.9ヵ月(HR 0.31、p<0.0001)、OS中央値は 9.8ヵ月と5.1ヵ月(HR 0.43、p<0.001)であった。
また、今回の結果から最もp値が小さくなるように計算されたcut-off値で評価した場合、奏効率はそれぞれ15.5%と0%、PFS中央値は5.1ヵ月と1.9ヵ月(HR 0.33、p<0.0001)、OS中央値は 9.9ヵ月と5.0ヵ月であった(HR 0.46、p<0.001)。

既治療mCRC患者でEREG高発現KRAS野生型の場合には、cetuximab治療効果が最も高いと考えられた。以前の報告に基づくEREG閾値では治療の必要のないKRAS野生型患者を十分に識別できなかったが、p値が最小になるよう設定されたEREG閾値ではそうした患者を識別できる可能性がある。一方、cetuximabを使用しない場合、EREG発現は予後を予測しなかった。
Use of Amphiregulin and Epiregulin mRNA expression in primary tumors to predict outcome in metastatic colorectal cancer treated with cetuximab. |
|
本試験では、mCRC患者の治療効果を予測するために、EREGおよびamphiregulin(AREG)を評価した。Cetuximab+CPT-11療法を受けた220例の原発腫瘍について、KRAS statusとAREG、EREGの発現を解析し、奏効率、PFS、OSとの関係を調べた。
その結果、AREGとEREGの発現は有意に相関しており(p<0.001)、原発腫瘍においてこれらのリガンドが同時に発現することが示された。KRAS変異型は204例中88例(43%)で確認された。KRAS野生型患者ではEREGとAREGの発現が有意に高く、EREGとAREGの発現は、奏効率および疾患制御率と相関した。
KRAS野生型でEREG/AREG高発現患者のPFS中央値は36週、OS中央値は65週であり、低発現患者に比べて有意に高値であったが(EREG/AREG低発現患者:それぞれ16週、31週)、KRAS変異型ではそのような傾向は認められなかった。
EREGまたはAREG発現の連続関数としての治療奏効予測のlog-hazard modelにより、治療奏効確率はKRAS変異型で低く、KRAS野生型では高いことが示された。
以上より、原発腫瘍のAREGとEREGの複合解析によって、cetuximab+CPT-11療法後のmCRC患者における予後予測能を高める可能性がある。
|
 |
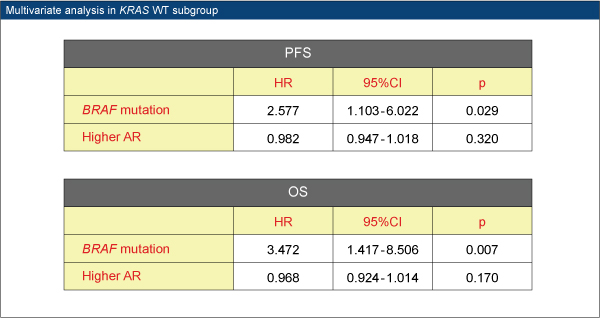
本試験では、CPT-11抵抗性のEGFR陽性mCRC患者コホートをレトロスペクティブに解析し、BRAF V600E変異とAREG発現について、KRAS野生型を対象に解析を行い、cetuximab+CPT-11療法に対する効果予測能を評価した。Cetuximab+CPT-11療法で治療した86例のうち、KRAS野生型は52例であった。
KRAS野生型におけるBRAF status別の奏効率はBRAF野生型30%(12/40例)、BRAF変異型10%(1/10例)であった。BRAF野生型群のPFS中央値は4.4ヵ月、OS中央値は13.0ヵ月、BRAF変異型群ではそれぞれ 3.3ヵ月、6.0ヵ月であり、いずれもBRAF野生型群で有意に延長された(PFS p=0.023、OS p=0.003)。
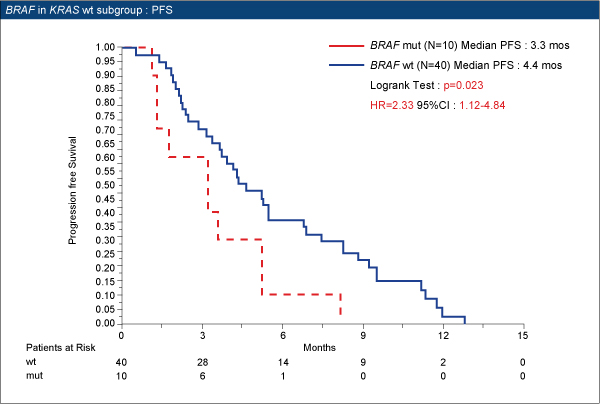
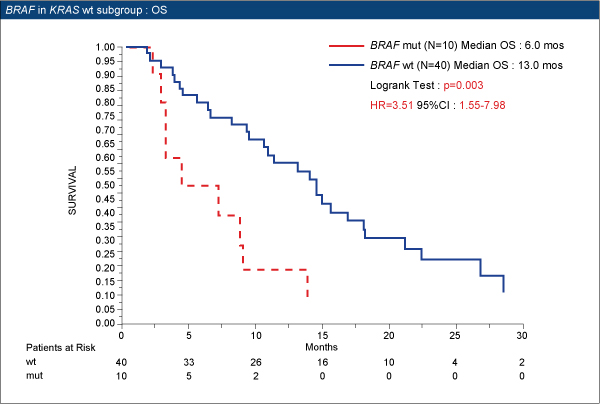
以上より、BRAF V600E変異は、KRAS野生型患者における治療抵抗性の予測因子であることが確認された。
AREGの高発現は奏効率、PFS、OSと相関傾向がみられたが、有意ではなかった。BRAF V600E変異型では、BRAF野生型に比べて、AREGの発現レベルが有意に低かった。また、多変量解析では、BRAF V600E変異はPFSとOSの予測因子であることが示され、AREG発現レベルは有意な予測因子とはいえなかった。
Epiregulin(EREG)やamphiregulin(AREG)はEGFRのligandであり、EGFよりも結合能は弱いが
生物学的活性が高いことが報告されており、cetuximabの効果規定因子の一つとして知られている。
今回、多施設共同臨床研究における標本を用いて、KRAS野生型でEREGやAREGが髙発現している症例では、cetuximabの効果が高いことが報告された。また、rasの下流に位置するBRAFの変異を有する症例では、KRASが野生型であってもcetuximabの効果が減弱する可能性が示唆された。いずれもこれまでの基礎的な研究の成果からすれば妥当な結果と思われる。しかし、遺伝子発現の測定方法、cut-off値の設定など未だ定まっておらず、今後さらに検討していくべき課題と思われた。
#4000-4002で瀧内先生がコメントされているように、これらのバイオマーカーに関する研究は、今後我が国が率先して取り組むべき課題であると思われる。
(コメント・監修:寺島 雅典)