Abstract #3509
結腸癌における術後補助化学療法としてのFOLFOX4 vs. FOLFOX4 + Bevacizumab または XELOX + Bevacizumabの国際共同無作為化比較第III相試験−AVANT試験のサブグループ解析
A multinational, randomized phase III study of bevacizumab (Bev) with FOLFOX4 or XELOX versus FOLFOX4 alone as adjuvant treatment for colon cancer (CC): Subgroup analyses from the AVANT trial.
Thierry André, et al.

結腸直腸癌ではVEGF発現の亢進が浸潤、血管密度、転移、再発に関連している。抗VEGF抗体薬であるBevacizumabの術後補助化学療法における役割を検証するためにAVANT試験が計画・実施され、2011年の消化器癌シンポジウムでBevacizumab上乗せの有用性が認められなかったことが報告された1)。今回の2011年 米国臨床腫瘍学会年次集会では、本試験におけるサブグループ解析が報告された。
Stage IIIもしくはハイリスクStage IIの結腸癌切除症例が適格となった。症例は登録地域、術後stageで層別化され、Arm A (n=955): FOLFOX4 24週、Arm B (n=960): FOLFOX4 + Bevacizumab 24週→ その後、Bevacizumab単剤で24週、Arm C (n=952): XELOX + Bevacizumab 24週→ その後、Bevacizumab単剤で24週の3群に無作為割付された。
主要評価項目はStage III結腸癌におけるDFS (disease-free survival) であり、副次評価項目にはOS (overall survival)、安全性が含まれた。DFSとOSの追跡は再発・死亡が確認されない場合は、無作為割付後4年まで6ヵ月毎に行われた。
主要評価項目はStage III結腸癌におけるDFS (disease-free survival) であり、副次評価項目にはOS (overall survival)、安全性が含まれた。DFSとOSの追跡は再発・死亡が確認されない場合は、無作為割付後4年まで6ヵ月毎に行われた。
2004年12月から2007年6月までに34ヵ国330施設から3,451例 (stage IIIは2,867例) が試験に登録された。年齢中央値は58-59歳であった。本発表における追跡期間中央値は48ヵ月 (0-66) であった。
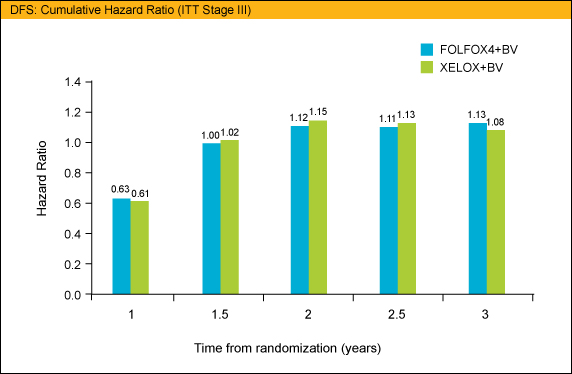
主要評価項目であるDFSに関しては、Arm Aに対するArm Bの比較ではHR=1.17 (95%CI: 0.98-1.39)、Arm Aに対するArm Cの比較ではHR=1.07 (95%CI: 0.90-1.28) といずれも優越性を示すことができなかった。DFSのハザード比は、いずれも無作為割付後1年の段階では良好な値であったが、Bevacizumabの中止後、上昇していることが示された。
主要評価項目であるDFSに関しては、Arm Aに対するArm Bの比較ではHR=1.17 (95%CI: 0.98-1.39)、Arm Aに対するArm Cの比較ではHR=1.07 (95%CI: 0.90-1.28) といずれも優越性を示すことができなかった。DFSのハザード比は、いずれも無作為割付後1年の段階では良好な値であったが、Bevacizumabの中止後、上昇していることが示された。
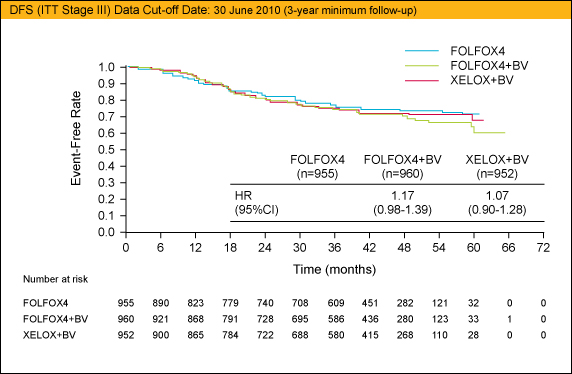
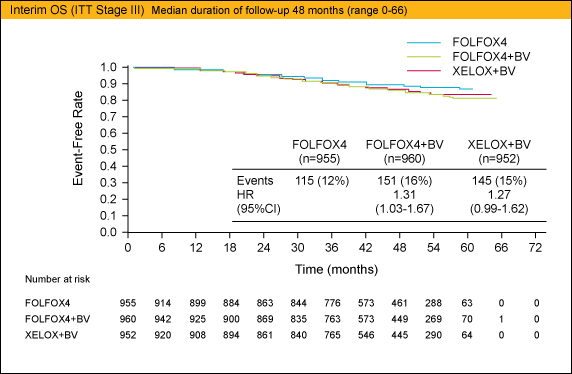
副次評価項目であるOSに関しては中間解析結果が報告されているが、Arm Aに対するArm Bの比較ではHR=1.31 (95%CI: 1.03-1.67)、Arm Aに対するArm Cの比較ではHR=1.27 (95%CI: 0.99-1.62) とOSに関しても優越性を示すことができなかった。
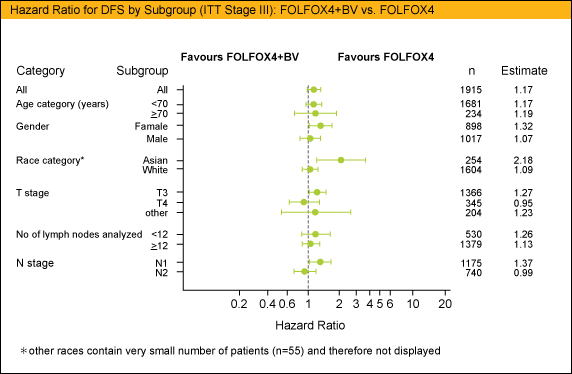
今回の解析ではStage IIIの症例に対して年齢(70歳以上/未満)、性別、人種(アジア人/白色人種)、T stage(T3/T4/他)、リンパ節検索個数 (12個以上/未満)、N stage (N1/N2) でサブグループ解析を行ったが、いずれの解析結果もstage III全体の結果と同様の傾向を示した。
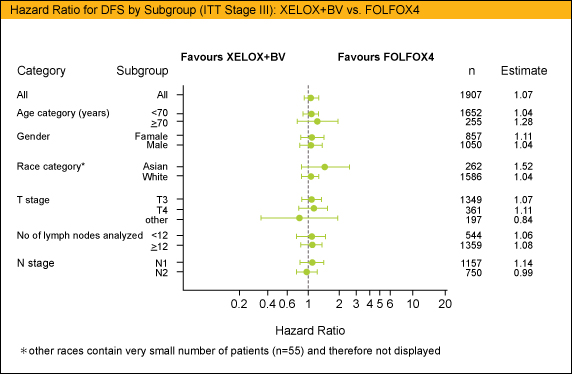
Stage III結腸癌における術後補助化学療法において、FOLFOX4もしくはXELOXにBevacizumabを加えてもDFSの改善は得られず、FOLFOX4のみでの治療で良好な傾向が示された。
今回報告されたDFSに対するサブグループ解析の結果はStage III全体の結果と一致したものであった。生存の追跡は割付後5年である2012年6月まで継続する予定である。
今回報告されたDFSに対するサブグループ解析の結果はStage III全体の結果と一致したものであった。生存の追跡は割付後5年である2012年6月まで継続する予定である。
本学会では進行大腸癌切除症例に対するBevacizumabを含む術後補助化学療法の有用性検証試験において有用性が認められずと報告されたC-08試験2)およびAVANT試験の追加解析報告が行われた。いずれの報告からも、stage II/III症例に対するBevacizumab併用投与による再発予防効果は認められず、これまでの結果通り、術後補助化学療法としては、FOLFOXに代表されるOxaliplatinを含むレジメンのみが推奨されることになる。これまでに、Bevacizumabのほか、Cetuximab、Irinotecanが否定されており、今後の新たな薬剤の登場を待つことになる。また、Bevacizumabは投与期間中のみ効果が認められた可能性があり、今後術後stage IV症例に対する使用の期待はまだ残される。この場合空想の域だが、経済的問題を無視すれば長期投与となり、副作用管理の面からOxaliplatin投与の一定期間以降はフッ化ピリミジン系経口抗癌薬との併用などが候補になるかもしれない。
(レポート: 結城 敏志 監修・コメント: 佐藤 温)

このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。
