


胃癌における分子標的薬の発展は、大腸癌に比べると遅れていると言わざるを得ない。
ToGA studyにおいて、Trastuzumabの報告がなされてはいるが、胃癌患者全体の20%以下という、限られた患者群においてのみ使用できる薬剤であるに過ぎない。その後、期待されたBevacizumabもAVAGAST studyがnegativeに終わったため、誰もが落胆していた。
そんな中、Cetuximabは大腸癌において、updateのデータではあるが1st-lineでOS (overall survival) を有意に延長させており (CRYSTAL)、また頭頸部癌でもOSの延長を示した (EXTREME) 分子標的薬であることから、当然の如く胃癌においてもその効果は大きく期待されていた。
しかし、今回の報告では、PFS (progression-free survival)、OSともにその延長を示すことはできなかった。筆者らも含めて日本の研究者も、この試験に参加していただけに、この結果は非常に残念であった。コントロールアームのXP群はPFSが5.6ヵ月と妥当であったが、HRは1.091とその上乗せを示すことができず非常に残念な結果であった。また奏効率に関してもその上乗せ効果は認められなかった。さらに、サブグループ解析も実施されたが、検討に値する様な結果は報告されなかった。
胃癌においては、前述のBevacizumab (AVAGAST)、Panitumumab (REAL3) においても分子標的薬の上乗せはnegativeな結果であり、今後も、all comerでの登録で有効性を示すことには限界があるのかもしれない。本試験では、十分な症例数が集められており、その組織検体も相当数ある事から、それらを無駄にすることなく、その検体を用いた、何らかのバイオマーカー探索が必要であり、それらによる、新たなる患者選択の可能性に期待したい。
進行胃癌ではEGFR過剰発現がみられるため、EGFR経路は腫瘍増殖と転移において重要であると考えられる。また、Cetuximabは、切除不能進行・再発大腸癌や頭頚部扁平上皮癌に対する有効性と安全性が認められており、進行胃癌に対する第II相試験においても良好な結果を示している1-3)。
進行胃癌患者870例を無作為にXP (Capecitabine + Cisplatin) 群とXP + Cetuximab群の2群に割り付け、原疾患の増悪または忍容できない毒性が起こるまで治療を継続した (図1)。
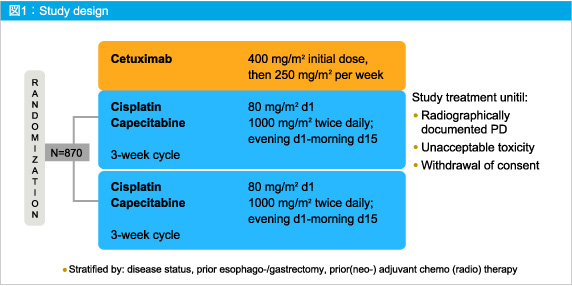
主要評価項目はPFSで、副次評価項目は、OS、奏効率、安全性、QOL、バイオマーカーであった。
なお、統計学的仮説として期待値をPFS中央値5.6〜7ヵ月、OS中央値10〜12.5ヵ月と設定し、検出力80%、有意水準片側5%としたところ、イベント数631件、症例数870が必要となった。イベント (PFS) 数が下回ったことから、プロトコルは修正され、イベント数631件、または2012年3月31日までのいずれかが到達した際に最終解析することとなった。
2008年6月から2010年12月の間に、25ヵ国164地域から904例が登録された。なお、DSMB (Data and Safety Monitoring Board) により検出された心イベントのため、2009年に登録が一時的に中断されたが、心イベント評価プログラムの実行後に登録が再開された。また、最終解析のためのデータカットオフは2012年3月31日に実行された。2群間の患者特性に有意な差はみられなかった (表1)。
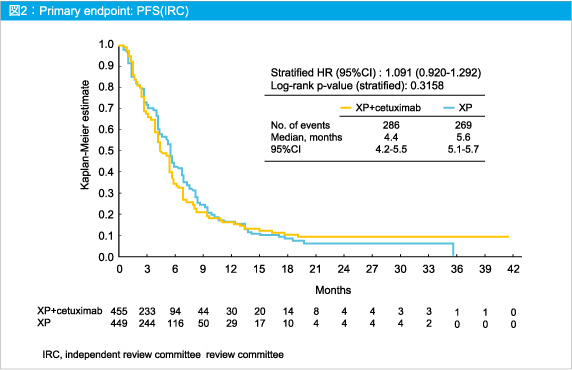
主要評価項目であるPFSはXP群で5.6ヵ月、XP + Cetuximab群で4.4ヵ月と、Cetuximab併用による有意な延長はみられなかった (HR=1.091, 95%CI: 0.920-1.292, p=0.3158) (図2)。
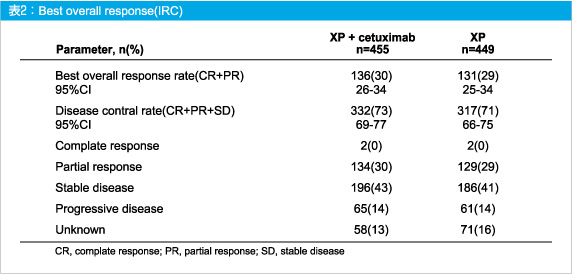
副次評価項目であるOSはXP群で10.7ヵ月、XP + Cetuximab群で9.4ヵ月であった (HR=1.004, 95%CI: 0.866-1.165, p=0.9547)。また、奏効率はXP群で29% (131/449例)、XP + Cetuximab群で30% (136/455例) であり、病勢コントロール率 (CR + PR + SD) はそれぞれ71% (317例)、73% (332例) と、いずれも差を認めなかった (表2)。
また、年齢、性別、人種、病期などによるサブグループ解析においても、いずれのグループでも差を認めなかった。
血液毒性 (全Grade) では、好中球減少がXP群55%、XP + Cetuximab群44%と最も多く、次いで貧血がそれぞれ37%、29%と多かった。
また、抗EGFR抗体薬に特徴的な有害事象である皮膚障害は、XP群15%、XP + Cetuximab群77%と、XP + Cetuximab群で高値であった。なお、下痢、手足症候群、低マグネシウム血症、低カリウム血症においてもXP + Cetuximab群で多い傾向にあった。心臓関連有害事象についてはXP群9.2%、XP + Cetuximab群13%であった。
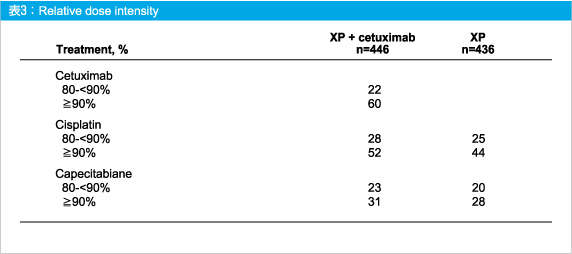
相対的用量強度は、XP + Cetuximab群のCetuximab については90%以上が60%、80〜90%が22%であった。なお、CisplatinとCapecitabineの相対的用量強度は、XP群とXP + Cetuximab群でほぼ同等であった (表3)。
進行胃癌に対する1st-line治療において、XP療法へのCetuximab上乗せ効果は示されなかった。サブグループについても同様で、その結果は一貫していた。なお、今回の登録症例の97%から評価可能な組織が得られており、現在、バイオマーカー解析が進行中である。
1) Lordick F, et al.: Br J Cancer. 102(3): 500-505, 2010[PubMed]
2) Moehler M, et al.: Ann Oncol. 22(6): 1358-1366, 2011[PubMed]
3) Pinto C, et al.: Br J Cancer. 101(8): 1261-1268, 2009[PubMed]
関連リンク
・2009年 米国臨床腫瘍学会年次集会 abst #LBA4509「ToGA試験の有効性に関する成績:HER2陽性進行胃癌における1st-line治療としての標準的化学療法+trastuzumabの効果 (第III相試験) 」
・2010年 米国臨床腫瘍学会年次集会 abst #LBA4007「AVAGAST試験:進行胃癌初回治療例に対するcapecitabine + cisplatin + bevacizumab療法とcapecitabine + cisplatin + placebo療法の無作為化第III相試験」
・2007年 米国臨床腫瘍学会年次集会 私が選ぶベスト3「Extreme study」
・2010年 消化器癌シンポジウム abst #281「再発大腸癌におけるcetuximab + FOLFIRI療法:バイオマーカーとしてのKRAS 、BRAF の影響: CRYSTAL試験の最新結果」
・2012年 米国臨床腫瘍学会年次集会 abst #LBA4000「進行食道・胃腺癌におけるEpirubicin + Oxaliplatin + Capecitabine (EOC) 療法 ± Panitumumabの無作為化比較第II/III相試験 (REAL3)」
・副作用対策講座「皮膚障害-1 分子標的薬の皮膚障害」
