背景と目的
Regorafenibは血管新生性 (VEGFR、TIE-2)、間質組織性 (PDGFR-β、FGFR) および腫瘍形成性 (c-KIT、RET、B-RAF) 受容体チロシンキナーゼを標的とする経口マルチキナーゼ阻害剤であり、ImatinibおよびSunitinibに不応となった切除不能GISTを対象とした第II相試験において良好な成績が報告されている1)。今回、同対象に対するRegorafenibの有効性を検証する目的で第III相比較試験が行われた。
対象と方法
- 対象: ImatinibおよびSunitinibに不応となった切除不能GIST
- 方法: 対象をRegorafenib (160mg/day、3週投与1週休薬) + BSC群とplacebo + BSC群に2:1の割合で無作為に割り付けた (層別因子: 前治療歴 [2 vs. >2]、地域 [アジア vs. アジア以外])。病勢が進行した際は二重盲検を解除し、placebo群にはRegorafenibの投与を、Regorafenib群にはRegorafenibの継続を提示し、再度病勢が進行するまで治療を継続することとした。
- 検討項目:
- ・主要評価項目:PFS (progression-free survival)、期待される両群間の差 100%
(HR=0.5)、片側α=0.01、検出力90% - ・副次評価項目:OS (overall survival)、TTP (time to progression)、ORR
(objective response rate)、DCR (disease control rate) など
- ・主要評価項目:PFS (progression-free survival)、期待される両群間の差 100%
結果
2011年1月から7月の間に17ヵ国より199例が登録され (Regorafenib群133例、placebo群66例)、2012年1月の有効性に関する最終解析において、主要評価項目のPFSがRegorafenib群で極めて有意に良好であったことから二重盲検が解除された。
患者背景は両群間に大きな隔たりはなく、全例でImatinibおよびSunitinib投与歴を有し、Nirotinib、他のチロシンキナーゼ阻害薬の投与歴はRegorafenib群で各々21.8%、1.5%、placebo群で30.3%、1.5%であった。PFSの中央値はRegorafenib群4.8ヵ月、placebo群0.9ヵ月で (HR=0.27, p<0.0001) (図1)、サブグループ解析においてもImatinib治療期間が6ヵ月未満の群 (n=22) でHRの95%CIが1を跨いでいたが、その他すべてのサブグループにおいてRegorafenib群が有意に良好であった (図2)。
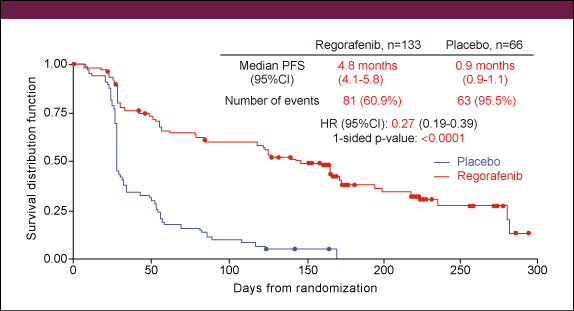 図1
図1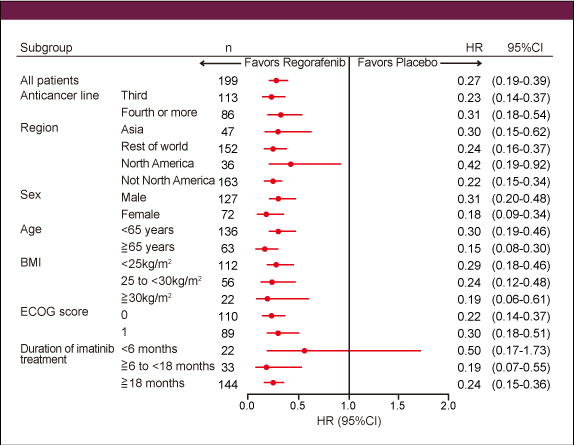 図2
図2解析時点でplacebo群の85%に後治療としてRegorafenibが投与されており、両群ともに中央値には到達しておらず、HRは0.77、p値は0.199であった (図3) 。
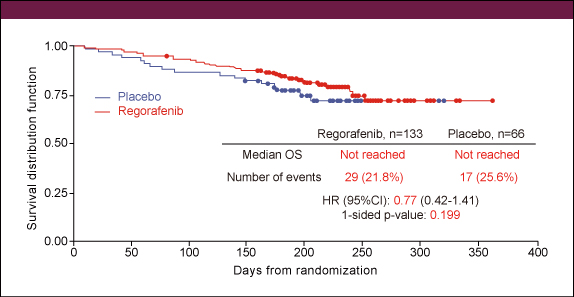 図3
図3主治医評価におけるRegorafenib群のPFSは7.4ヵ月、placebo群の後治療としてRegorafenibが投与された症例のPFS (後治療) は5.0ヵ月であった (図4) 。ORRは各々4.5%、1.5%、DCRは52.6%、9.1%であった。
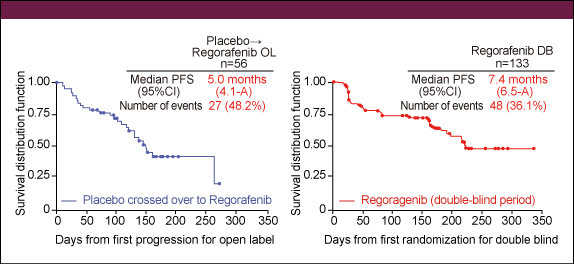 図4
図4 Regorafenib群のgrade 3以上の主な有害事象は手足症候群 (19.7%)、高血圧 (22.7%)、下痢 (5.3%)、有害事象による治療中止はRegorafenib群で6.1%、placebo群で7.6%であった。
GISTにおける遺伝子型の情報が得られたのはRegorafenib群で45.1%、placebo群では54.5%であった。KIT 遺伝子エクソン11変異は各々56.7%、47.2%、エクソン9変異は15.0%、16.7%に認め、いずれの変異においてもRegorafenib群で有意にPFSが良好であった (表)。
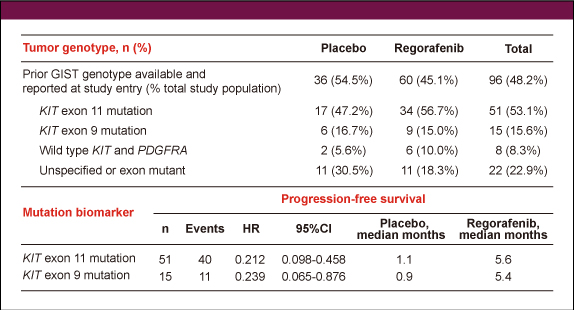 表
表結論
RegorafenibはImatinibおよびSunitinibに不応となった切除不能GISTのPFSを有意に延長させ、有害事象も予期できる範囲内であったことより、同対象に対する新しい標準治療となりうる。
コメント
GISTは10万人あたりに1~2人と、極めて希な悪性腫瘍である。あらゆる既存の抗癌剤や放射線治療が全く無効であることから、近年ImatinibやSunitinibといった経口分子標的薬が登場するまでは、切除不能・再発GISTの治療は困難を極めていた。その2剤に耐性となったGISTに対する薬剤は皆無であり、対象患者や担当医師は、次代の薬剤の誕生を心待ちにしていた。
Regorafenibは前述の如く経口マルチキナーゼ阻害剤であり、SunitinibやSorafenibのように手足症候群などの薬剤特異的な副作用をもつコントロールが極めて難しい薬剤でもある。そのような状況であるにもかかわらず、本試験はわずか6ヵ月で199例を集積したことからも、いかに待望された薬剤であるかが量られる。PFS中央値はRegorafenib群4.8ヵ月、placebo群0.9ヵ月 (HR=0.27, p<0.0001) (図1) と極めて有効な結果であり、早期の治験終了となった。盲検であるがPD確認後は実薬が投与でき、患者にとっても優しい治験となったが、当然OSのグラフは近似し、差が出ない結果となっている。
Regorafenibは、大腸癌でも同様の投与法でglobal試験が展開され、そちらもpositive試験となった2)。本試験もglobal試験であり、筆者を含めた日本のinvestigatorも参加しているため、この結果をもって本邦の患者さんにも承認申請が可能となり、過去の時代にあった “諸外国では承認されているのに、我が国では使えない” というdrug lagの解消にも貢献できている。何よりも、耐性GIST患者さんたちにとって福音となることは間違いないものと思われる。
(レポート:山﨑 健太郎 監修・コメント:小松 嘉人)
- Reference
-
- 1) George S, et al.: J Clin Oncol. May 21, 2012 (epub ahead of print)
- 2) Van Cutsem E, et al.: 2012 Annual Meeting of the American Society of Clinical Oncology®: abst #3502[学会レポート]

