背景
FIRIS試験は二次化学療法例を対象としてIrinotecan (CPT-11) + S-1療法 (IRIS) のFOLFIRI療法に対する非劣性を検証した試験であるが、主要評価項目のPFS (progression-free survival) において非劣性が報告されている1)。すでに一次治療例を対象としてIRISにBevacizumab (BEV) を上乗せしたIRIS + BEV療法の有効性と安全性を報告しているが2)、今回、長期追跡調査の結果を報告した。
対象と方法
主な適格基準は、腺癌の組織診断がついている切除不能大腸癌症例であり、年齢20歳以上、ECOG PS 0-1、化学療法歴のない症例とされた。S-1は40-60mgを1日2回14日間内服、14日間休薬。CPT-11 100mg/m2、BEV 5mg/kgをday 1・15に点滴静注し、28日を1サイクルとして継続した(図1)。
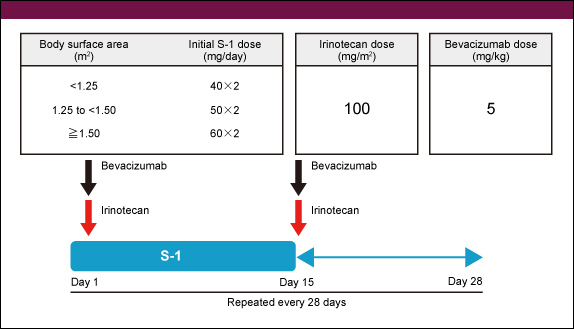 図1
図1主要評価項目は安全性、副次評価項目は奏効率、PFS、OS (overall survival) として試験が行われた。
結果
2009年3月までに試験に参加した9施設より53例が登録された。評価可能病変を有さなかった1例を除外して52例で解析が行われた。患者背景は、年齢中央値が63.5歳、男女比は3:2、PSは全例で0であった。
2012年1月に行った追跡調査の結果、主なgrade 3/4の有害事象は好中球数減少27%、下痢17%、食欲不振4%、口内炎2%、高血圧21%であり、BEVに特徴的な消化管穿孔は認めなかった (表1)。
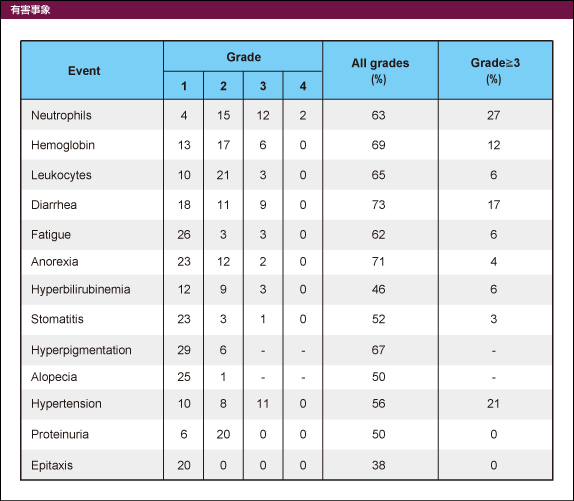 表1
表1奏効率は63.5%であり、3例がCRであった(表2)。PFS中央値は17.0ヵ月、OS中央値は39.6ヵ月であった (図2、3)。
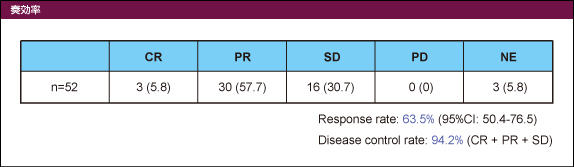 表2
表2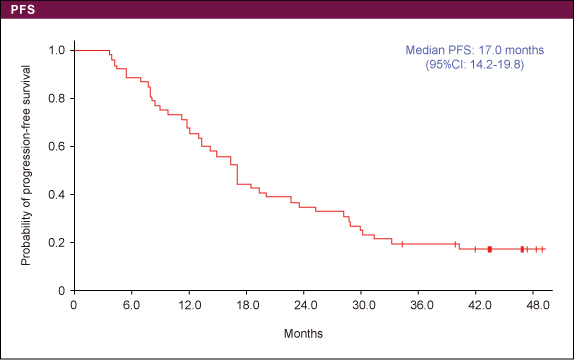 図2
図2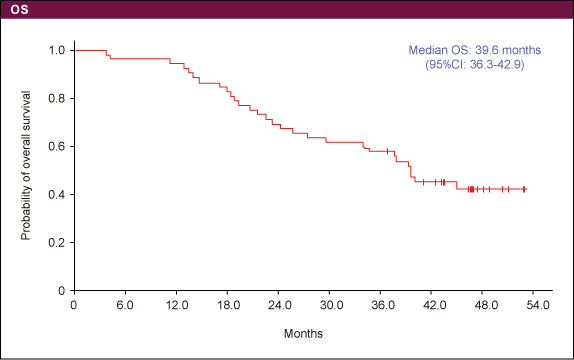 図3
図3全52例中、腫瘍縮小により転移巣を含めた根治切除に移行できた症例は7例 (13.5%) であり、肝転移のみを有していた症例 (n=13) に限定すると4例 (30.8%) が根治切除へ移行した。
結論
切除不能大腸癌に対する一次治療としてのIRIS + BEV療法は有効性が強く期待され、有害事象も許容範囲内であった。現在、Oxaliplatinベースの化学療法 (mFOLFOX6 or XELOX + BEV) とCPT-11、S-1、BEV併用療法 (IRIS + BEV or SIRBレジメン) の無作為化比較第III相試験 (TRICOLORE study) が進行中であり、初回治療での有効性を検証中である。
コメント
我が国から発表された数少ない大腸癌の発表である (因みに今年はCRCではPoster Discussion 1題、Poster 6題が採択されている) 。切除不能大腸癌に対して既に有効性・安全性が確認されているIRIS療法に、BEVを併用したIRIS + BEV療法の長期成績の報告である。以前に奏効率が高いことは報告済みであるが2)、PFS中央値が17ヵ月、生存期間中央値が39.6ヵ月と、第II相試験であることを考慮しても驚くべき成績が得られていた。IRISの分子標的薬との相性のよさもその一因となっているものと思われる。S-1はアジア人には大変使用しやすい薬剤であるので、経口抗癌剤の利便性を活かした治療開発が我が国を中心として進められるべきである。今後、HGCSG、TCOG、T-COREのIntergroup studyとして行われるTRICOROLE試験の結果に期待したい。
(レポート:結城 敏志 監修・コメント:寺島 雅典)

