| |
●GISTを対象としたGRID試験
吉野:次に、西田先生からGISTに対するGRID試験を紹介していただきます。
西田:GISTは消化管の肉腫で、Imatinibが有効であることが知られていますが、約2年で半数が耐性になり、2nd-lineとしてSunitinibが使われます。しかし、Sunitinibも8ヵ月ほどで耐性になるため、その後に使用できる薬剤が待ち望まれていました。
Regorafenibは海外の第II相試験において、PFS中央値で10ヵ月という優れた成績を残したため10)、第III相試験が実施されました。なお、追跡期間中央値8.3ヵ月の時点でOSは中央値に未到達でありました。
GRID試験には日本を含めた17ヵ国が参加し、ImatinibおよびSunitinibに耐性となったKIT 陽性のGIST患者199例をRegorafenib群(160mg/day, 3週投与1週休薬)またはplacebo群に2:1の割合で無作為に割り付けられました11)。アジア人はRegorafenib群34例 (日本人12例)、placebo群16例 (日本人5例) です。なお、Sunitinib以外のVEGFR阻害剤を受けた症例は除外し、placebo群で増悪した症例はクロスオーバーできるようになっています。また、Regorafenib群で増悪した症例においても、治験責任医師の判断でRegorafenibの継続投与が許容されていました。
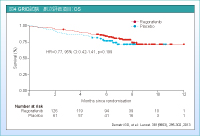
結果、主要評価項目のPFS中央値はplacebo群0.9ヵ月に対してRegorafenib群4.8ヵ月と有意な延長を認めました (HR=0.27, 95% CI: 0.19-0.39, p<0.0001) (図3)。アジア人のサブグループ解析では、それぞれ1.1ヵ月、3.9ヵ月と、ITT解析と比べて若干劣るものの、ほぼ同様の成績でした (HR=0.301, 95% CI: 0.146-0.621, p=0.00030) 12)。その他のサブグループも、Imatinibの治療期間が6ヵ月未満 (HR=0.50, 95% CI: 0.17-1.73) を除き、すべてRegorafenib群が有意に良好でした。
クロスオーバーを行っているため、OSに有意差は認められませんでしたが (HR=0.77, p=0.199) (図4)、Regorafenib群がやや高値で推移していることから、早期の導入に意義があると思われます。なお、抗腫瘍効果についてもplacebo群がPR 1.5%、SD 33.3%に対して、Regorafenib群はPR 4.5%、SD 71.4%であり、病勢コントロール率 (CR+PR+12週以上持続するSD) は、Regorafenib 52.6%, placebo 9.1%とRegorafenib群で改善が認められており、waterfall plotを見ても約半数の症例に腫瘍縮小が認められています。
GISTの場合は遺伝子変異が非常に重要ですが、ImatinibおよびSunitinib投与前の一次遺伝子変異別に見ると、KIT exon 11変異例 (HR=0.212)、KIT exon 9変異例 (HR=0.239) いずれに対しても有効性を示しており、KIT exon 11変異例で効果が低いSunitinibとは少し性質が異なるようです。
有害事象は大腸癌と同じく、手足症候群、高血圧、消化器症状などが多く発現しています。なお、興味深いことに、Regorafenib治療後の増悪例に対するRegorafenib継続投与により、増悪後PFS中央値は4.5ヵ月と効果がみられています13)。
 |