| |
●大腸癌患者を対象としたCORRECT試験
吉野:それでは、続いてRegorafenib の第III相試験である2つの試験を紹介していただきます。まず、大腸癌のCORRECT試験について、辻先生からお願いします。
辻:CORRECT試験は日本を含む世界16ヵ国114施設が参加した、国際共同第III相試験です。本試験の結果は2012年のGastrointestinal Cancers Symposiumで報告され、2013年Lancet誌に論文が掲載されました7)。すべての標準治療に抵抗性となり、ECOG PS 0/1の大腸癌患者760例をRegorafenib群 (160mg/day, 3週投与1週休薬) とplacebo群に2:1で無作為に割り付けられました。患者背景はバランスがとれており、Bevacizumab使用歴は両群ともに100%でした。
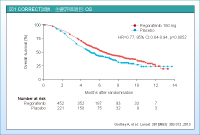
主要評価項目のOS (overall survival) 中央値はplacebo群5.0ヵ月、Regorafenib群6.4ヵ月とRegorafenib群で有意な延長が示されました (HR=0.77, 95% CI: 0.64-0.94, p=0.0052) (図1)。また、2012年のESMOで発表されたOSのupdate解析でも、OS中央値は同様であり、HR=0.79 (95% CI: 0.66-0.94, p=0.0038) と優れた成績が示されています8)。
PFS中央値はそれぞれ1.7ヵ月、1.9ヵ月と中央値にはあまり差はありませんが、近年の分子標的薬の試験と同様に、途中からPFS曲線が開いています (HR=0.49, p<0.0001) (図2) 7)。なお、2012年7月末の日本臨床腫瘍学会で発表された日本人のサブグループ解析でも、PFS中央値はplacebo群51日、Regorafenib群59日 (HR=0.467, p=0.000431) と同様の結果が認められています9)。
また、病勢コントロール率もplacebo群15%、Regorafenib群41%と有意に良好で (p<0.0001)、サブグループ解析では前治療歴、KRAS statusなど、総じてRegorafenib群が良好でした7)。
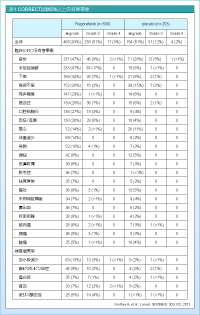
有害事象としては手足症候群が47% (grade 3: 17%) に認められており (表1) 7)、実際に我々の施設でも、裂けるように皮が剥ける症例を何例か経験しました。また、高ビリルビンが9%認められており、肝機能についても注意する必要があります。Grade 3以上の倦怠感 (9%)、高血圧 (7%)、下痢 (7%)、皮疹・落屑 (6%) も認められているほか、日本では肝不全による死亡例が報告されているため、有害事象のマネジメントには注意が必要だと思います。

吉野:OSは有意差を認めたものの、中央値の差は1.4ヵ月ですが、この結果をどう解釈されますか。
辻:臨床試験は効果のない症例も含めて評価することになります。実際にRegorafenibを使用した経験では、効果がある人には非常に有効な薬剤であり、副作用をマネジメントしながら長期に継続することも可能でした。ただ、last-lineだからと、効果のない患者にRegorafenib投与を継続するようなことがなければ、この薬剤をもっと活かせるのではないかと思います。
吉野:適切な時期に評価して、効果がある人では長期に継続するということですね。
 |