
|
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内 で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。 |
KRAS 野生型切除不能進行・再発大腸癌患者のサルベージラインにおけるCPT-11ベース化学療法に対するCetuximabとPanitumumab併用療法の比較:HGCSG0901/1002試験からの解析
Comparison of Adding Cetuximab (Cmab) or Panitumumab (Pmab) to Irinotecan (IRI)-based Chemotherapy in Salvage-line against KRAS Wild Type Patients with Metastatic Colorectal Cancer (mCRC): Analysis of HGCSG0901 and 1002
Koshi Fujikawa, et al.

CPT-11併用時のCetuximabとPanitumumabは同等か?

今回、北海道消化器癌化学療法研究会より報告された本研究は、独立したPanitumumabとCetuximabの2つの後ろ向き研究のデータベースを用いて、KRAS exon 2野生型の症例に対して3rd-line以降にCPT-11を併用した際の有効性と安全性を比較したものである。後ろ向き研究ではあるものの、有効性・安全性ともに両薬剤間で大きな差異は認めず、OS、PFSに関しては、各背景因子を考慮した多変量解析においても有意差は認めなかった。
後ろ向き研究で、少数例の検討というlimitationもあり、結論づけたことは言えないが、同等性を示唆する結果である。現在、西日本がん研究機構 (WJOG) において、CPT-11 + PanitumumabとCPT-11 + Cetuximabを比較する無作為化比較第II相試験 (WJOG6510G) が進行中であり3)、その結果が待たれるところである。
抗EGFR抗体薬であるCetuximabおよびPanitumumab とCPT-11の併用療法は、切除不能進行・再発大腸癌患者に対して抗腫瘍効果・安全性が確認されているが1, 2, 4-6)、今回、CPT-11併用時におけるCetuximabとPanitumumabの有効性について直接比較した報告はない。北海道消化器癌化学療法研究会 (HGCSG) による2つの独立した後ろ向き試験7, 8)から、CPT-11 + CetuximabとCPT-11 + Panitumumabについての有効性、安全性のデータを比較解析した。
Cetuximabを含む治療について検討したHGCSG0901試験、およびPanitumumabを含む治療について検討したHGCSG1002 試験に登録された症例のうち、3rd-line以降でCPT-11 + Cetuximab/Panitumumabを施行したKRAS 野生型切除不能進行・再発大腸癌患者を対象とした、HGCSG0901試験の269例中96例、HGCSG1002試験の200例中27例が解析対象となった。
単変量解析は、レジメン、年齢、性別、ECOG PS、原発巣、原発巣切除の有無、肝転移の有無、肺転移の有無、腹膜転移の有無、Bevacizumab治療歴、転移臓器数についてlog-rank検定にて行い、p<0.2の変数についてはCox比例ハザードモデルにより多変量解析を行った。
単変量解析は、レジメン、年齢、性別、ECOG PS、原発巣、原発巣切除の有無、肝転移の有無、肺転移の有無、腹膜転移の有無、Bevacizumab治療歴、転移臓器数についてlog-rank検定にて行い、p<0.2の変数についてはCox比例ハザードモデルにより多変量解析を行った。
対象は、CPT-11 + Cetuximab群96例、CPT-11 + Panitumumab群27例であった。両群における患者背景のバランスはほぼとれていたが、Bevacizumab既治療例はCPT-11 + Panitumumab群で多かった (62.5% vs. 92.6%, p=0.002)。
Grade 3以上の有害事象は、低マグネシウム血症がCPT-11 + Panitumumab群で高い傾向がみられた (2.1% vs. 15.0%, p=0.053)、皮膚障害については差がみられなかった。
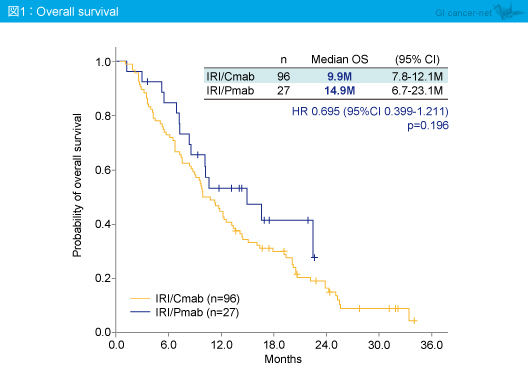
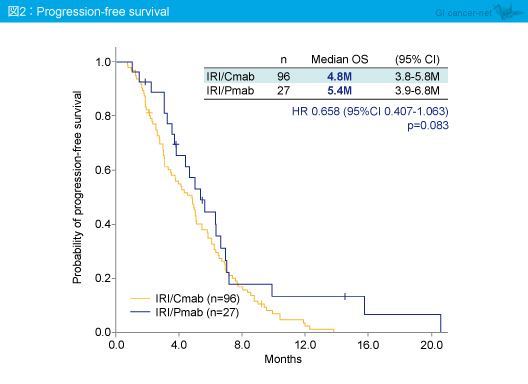
奏効率は、CPT-11 + Cetuximab群25%、CPT-11 + Panitumumab群18.5%であり (p=0.611)、OS中央値はそれぞれ9.9ヵ月、14.9ヵ月 (HR=0.695, 95% CI: 0.399-1.211, p=0.196) (図1)、PFS中央値はそれぞれ4.8ヵ月、5.4ヵ月であった (HR=0.658, 95% CI: 0.407-1.063, p=0.083) (図2)。
Grade 3以上の有害事象は、低マグネシウム血症がCPT-11 + Panitumumab群で高い傾向がみられた (2.1% vs. 15.0%, p=0.053)、皮膚障害については差がみられなかった。
奏効率は、CPT-11 + Cetuximab群25%、CPT-11 + Panitumumab群18.5%であり (p=0.611)、OS中央値はそれぞれ9.9ヵ月、14.9ヵ月 (HR=0.695, 95% CI: 0.399-1.211, p=0.196) (図1)、PFS中央値はそれぞれ4.8ヵ月、5.4ヵ月であった (HR=0.658, 95% CI: 0.407-1.063, p=0.083) (図2)。
単変量解析では、PFSでは、使用レジメン、ECOG PS (0 vs. 1/2)、転移臓器数 (1 vs. 2-4)、OSでは、使用レジメン、性別、ECOG PS、肝転移の有無、転移臓器数がp<0.20であった。上記変数について多変量解析を行った結果、PFSでは、ECOG PS (HR=1.487, p=0.049) が、OSではECOG PS (HR=2.108, p=0.001)、転移臓器数 (HR=1.647, p=0.045) で有意差を認めた。
本後ろ向き解析から、切除不能進行・再発大腸癌のサルベージラインにおいて、CPT-11 + CetuximabとCPT-11 + Panitumumabとの間に有効性に関する有意差は認められなかった。
Reference
| 1) | Cunningham D, et al.: N Engl J Med. 351(4): 337-345, 2004[PubMed] |
| 2) | André T, et al.: Ann Oncol. 24(2): 412-419, 2013[PubMed] |
| 3) | WJOG6510G:Irinotecan、Oxaliplatin、フッ化ピリミジン系薬剤不応/不耐のKRAS 野生型切除不能・再発大腸がんに対するPanitumumab + Irinotecan併用療法 対 Cetuximab + Irinotecan併用療法のランダム化第II相試験[UMIN-CTR] |
| 4) | Sobrero AF, et al.: J Clin Oncol. 26(14): 2311-2319, 2008[PubMed] |
| 5) | Shitara K, et al.: Invest New Drugs. 30(2): 787-793, 2012[PubMed] |
| 6) | Seymour MT, et al.: Lancet Oncol. 14(8): 749-759, 2013[PubMed] |
| 7) | Hatanaka K, et al.: 2012 Gastrointestinal Cancers Symposium: abst #634 |
| 8) | Kobayashi Y, et al.: 2013 Gastrointestinal Cancers Symposium: abst #541 |
