The European Cancer Congress 2013 - ESMO


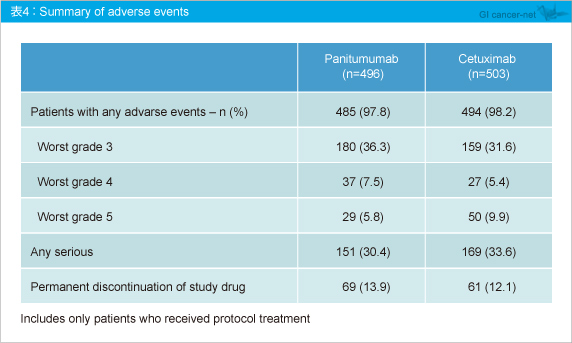
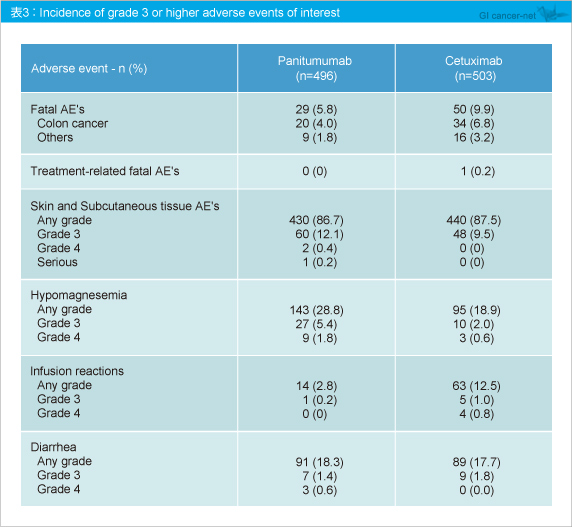
本試験において完全ヒト型IgG2モノクローナル抗体薬であるPanitumumabはキメラ型ヒト/マウスIgG1モノクローナル抗体薬のCetuximabに対してOS (overall survival) における非劣性を証明した。OS、PFS (progression-free survival) のKaplan-Meier曲線はほぼ重なっていること、Panitumumab群でCRが2例認められたが、奏効率に有意差は認めなかったことより、両薬剤の抗腫瘍効果には差異はないと考える。低マグネシウム血症がPanitumumab群で、Infusion reactionがキメラ型抗体であるCetuximab群で多い傾向にあったが、それら以外の皮膚障害、下痢といった治療を継続する上で問題となるような有害事象の発現頻度にも差異を認めなかった。本試験は片群500例、計1,000例規模の大規模試験にもかかわらず、PFSの中央値が約4ヵ月、OSの中央値が約10ヵ月と既報と同程度または良好な成績であり、試験の質も十分担保されていると考える。したがって、Panitumumabは2013年米国臨床腫瘍学会のPRIME試験のOS update解析に続き、本試験においてもOSに対する十分なエビデンスを構築できたものと考える。今後はQOL、背景因子による多変量解析、およびRAS 遺伝子を含めたバイオマーカー解析の結果が待たれる。
抗EGFR抗体薬はKRAS 野生型の切除不能進行・再発大腸癌患者に対して単剤で使用されることがある。Cetuximabは、NCIC CTG CO.17試験で3rd-lineにおいて単剤投与によるOSベネフィットが示されているが1)、Panitumumab単剤投与によるOSベネフィットは示されていない。
ASPECCT試験は、KRAS 野生型の切除不能進行・再発大腸癌症例を対象に、PanitumumabとCetuximabの有効性および安全性を比較する初の第III相試験である。
対象は18歳以上、ECOG PS 0-2の KRAS 野生型切除不能進行・再発大腸癌で、5-FU、L-OHP、CPT-11ベースの治療済みで、抗EGFR抗体薬未投与の症例である。Panitumumab群 (6mg/kg q2w) とCetuximab群 (初回400mg/m2、以降は250mg/m2 q1w) とに無作為に割り付けられ、PD、不耐性、患者拒否もしくは死亡するまで投与を継続し、試験中のクロスオーバーは認めなかった。なお、症例は地域 (北米、西欧、オーストラリア vs. その他の地域) 、ECOG PS (0/1 vs. 2) により層別化された。
主要評価項目はOSで、副次評価項目はPFS、奏効率、安全性とした。OSはCetuximabに対するPanitumumabの非劣性検定とし、CetuximabとBSCとを比較したNCIC CTG CO.17試験で得られたOSの結果 (9.5ヵ月 vs. 4.8ヵ月, HR=0.55)2) を対照としてsynthesis approachにより検証し、Z値が-1.96を下回った場合に非劣性が得られるものとした。また、Panitumumabによるretention rateもNCIC CTG CO.17試験の結果を用いて算出した。
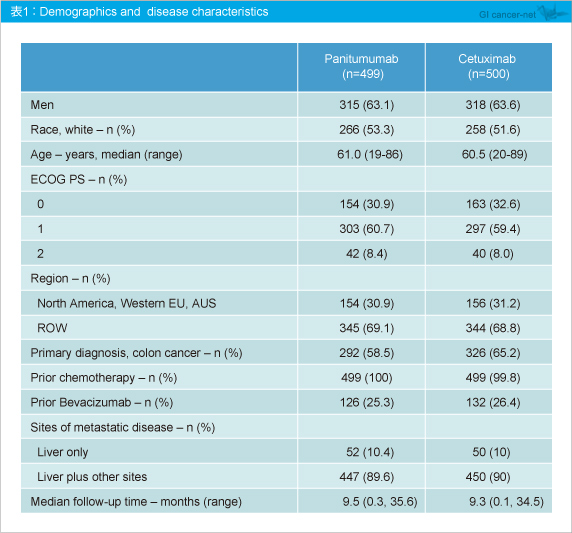
全999例が無作為に割り付けられ、Panitumumab群499例、Cetuximab群500例であった。患者背景は両群間でバランスが取れており、Panitumumab群の25.3%、Cetuximab群の26.4%にBevacizumab投与歴があった (表1) 。
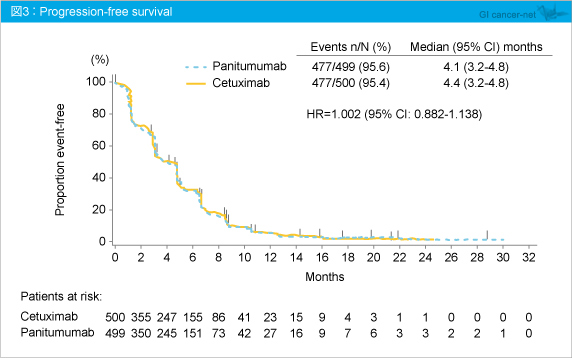
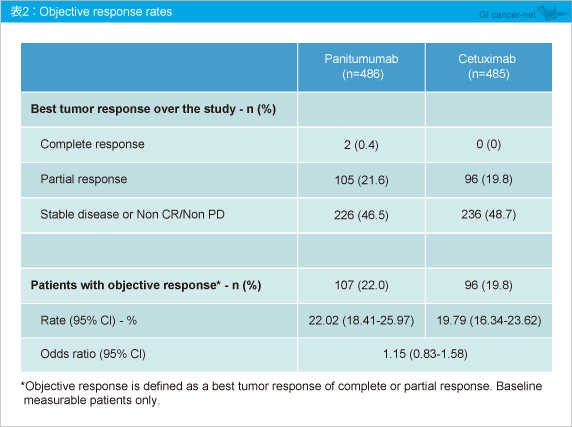
副次評価項目であるPFSは、Panitumumab群4.1ヵ月、Cetuximab群4.4ヵ月と差を認めなかった (HR=1.002, 95% CI: 0.882-1.138) (図3) 。奏効率はPanitumumab群22.0%、Cetuximab群19.8%と差は認められなかったが、Panitumumab群ではCRが2例みられた (表3) 。 有害事象の発現率も両群で同程度であった (表4) 。なお、低マグネシウム血症はPanitumumab群28.8%、Cetuximab群18.9%とPanitumumab群で高い傾向にあり、Infusion reactionはPanitumumab群2.8%、Cetuximab群12.5%とCetuximab群で高い傾向にあった (表5) 。
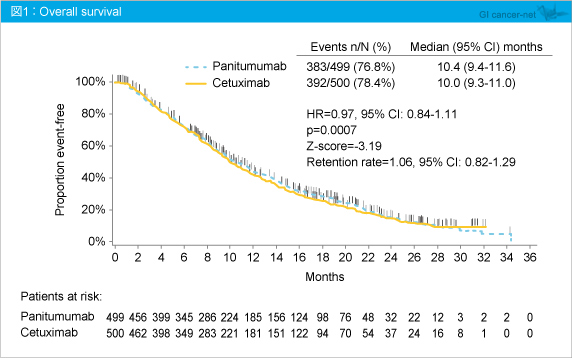
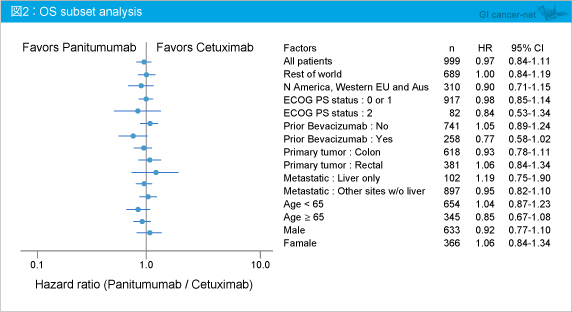
KRAS 野生型の切除不能進行・再発大腸癌に対して、PanitumumabのCetuximabに対するOSの非劣性が証明され、Panitumumabは、CetuximabのBSCに対するOSベネフィットの106%を保持した。安全性については、両群ともに従来の報告と同様であり、Panitumumabにおける新たな毒性は認められなかった。