|
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内 で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。
|

転移を有する膵癌に対するGemcitabine ± weekly nab-Paclitaxelの無作為化第III相試験: MPACT試験
Randomized Phase III Study of Weekly nab-Paclitaxel plus Gemcitabine vs Gemcitabine Alone in Patients with Metastatic Adenocarcinoma of the Pancreas (MPACT)
Daniel D. Von Hoff, et al.

膵癌治療に朗報! nab-PaclitaxelでOSが延長!

本会で報告されたMPACT試験はGem単独療法に対する、nab-Paclitaxel (nab-P) 併用の有効性を検証した第III相試験である。nab-PはPaclitaxelとヒト血清アルブミンの粒子から成るナノ粒子Paclitaxel製剤であり、投与後は血液中で速やかに粒子が崩壊して組織に移行する。nab-Pでは溶媒を使用していないため前投薬の必要はなく、生理食塩液に懸濁することが可能であることから、アルコール過敏症の症例にも投与可能である。また、nab-Pの点滴時間は30 分と短く、本邦では現在、乳癌に対して承認が得られており、進行胃癌に対しても承認が見込まれている。
本試験の主要評価項目であるOS (overall survival) の中央値はGem単独群の6.7ヵ月に対し、nab-P併用群で8.5ヵ月と有意差をもって延長が示された (HR=0.72, 95% CI: 0.617-0.835, p=0.000015)。またPFS (progression-free survival)、奏効率ともに有意な上乗せを示す完全勝利の結果であった。有害事象も概ね許容範囲内の結果であり、その使い勝手に関しても問題なさそうである。
本試験の結果は、現在の標準療法であるGem + Erlotinib (OS 6.24ヵ月、PFS 3.75ヵ月)1) を凌駕するものであり、間質性肺炎などの致死的な有害事象や有効性の観点から実臨床ではあまり使用されていないGem + Erlotinibに代わり、標準治療として第一選択になる可能性を十分に秘めている。しかし、同時に現在、承認申請へ向けて試験が進行しているFOLFIRINOXとの使い分けに関しても検討の余地がある。
とはいえ、残念ながら本邦から本試験への参加施設はなく、早期承認の夢は叶わない。本邦における早期の承認申請試験の完遂が望まれる。
nab-P (ABRAXANE®) は単剤で膵癌に有効なことが示されており、Gemとの相乗効果も確認されている3, 4)。67例を対象としたnab-P + Gemの第I/II相試験では、最大耐用量 (MTD) はnab-P 125mg/m2 + Gem 1,000mg/m2 (day1, 8, 15) の4週投与であり、この用量での奏効率は48%、PFS中央値は7.9ヵ月、OS中央値は12.2ヵ月と有望な結果が報告されている3)。
MPACT試験は、転移を有する膵癌の治療におけるGem ± weekly nab-Pの国際的な大規模無作為化第III相試験である。
MPACT試験は、転移を有する膵癌の治療におけるGem ± weekly nab-Pの国際的な大規模無作為化第III相試験である。
対象はstage IVの膵癌で、転移病変に対する治療歴がなく、Karnofsky PS (KPS) ≧70%の患者とし、nab-P 125mg/m2 + Gem 1,000mg/m2 (day1, 8, 15を4週毎) を投与する群 (nab-P + Gem群) と、Gem 1,000mg/m2 (週1回投与を7週後に1週休薬し、引き続きday1, 8, 15を4週毎) を投与する群 (Gem群) とに1:1に無作為に割り付けられた (図1)。
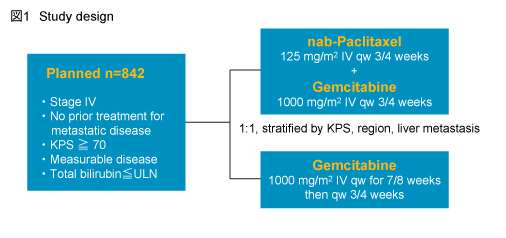
主要評価項目はOS、副次評価項目は独立評価委員会判定によるPFSおよび奏効率であった。
2009年5月8日〜2012年4月17日までに11ヵ国151施設から861例が登録され、nab-P + Gem群に431例、Gem群に430例が割り付けられた。なお、ベースラインの患者背景は両群でよくバランスがとれていた。
OS中央値はnab-P + Gem群8.5ヵ月、Gem群6.7ヵ月であり、nab-P + Gem群で有意な延長が認められた (HR=0.72, 95% CI: 0.617-0.835, p=0.000015) (図2)。
OS中央値はnab-P + Gem群8.5ヵ月、Gem群6.7ヵ月であり、nab-P + Gem群で有意な延長が認められた (HR=0.72, 95% CI: 0.617-0.835, p=0.000015) (図2)。
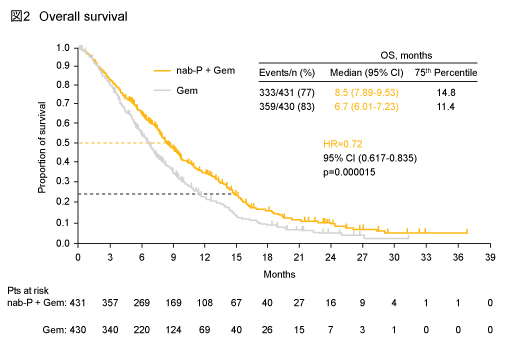
12ヵ月OSはnab-P + Gem群35%、Gem群22% (p=0.00020)、24ヵ月OSはそれぞれ9%、4% (p=0.02123) と、いずれもnab-P + Gem群において有意な延長が認められた。また、KPS 70-80% (HR=0.61)、肝転移例 (HR=0.69)、転移数3個超 (HR=0.50)、CA19-9 59×ULN以上 (HR=0.61) など、事前に規定されたサブグループの多くでnab-P + Gem群はGem群よりも良好であった。
独立評価委員会判定のPFS中央値はnab-P + Gem群5.5ヵ月、Gem群3.7ヵ月と、nab-P + Gem群において有意な延長が認められた (HR=0.69, 95% CI: 0.581-0.821, p=0.000024) (図3)。
独立評価委員会判定のPFS中央値はnab-P + Gem群5.5ヵ月、Gem群3.7ヵ月と、nab-P + Gem群において有意な延長が認められた (HR=0.69, 95% CI: 0.581-0.821, p=0.000024) (図3)。
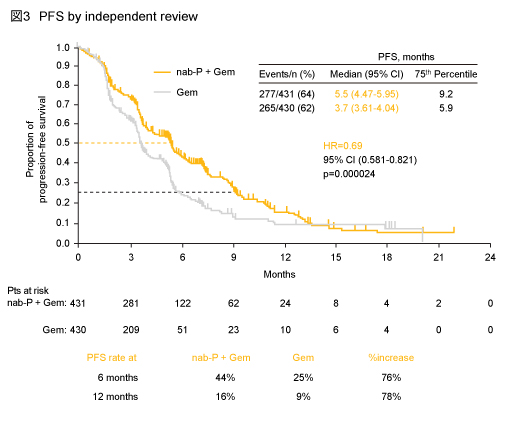
PFSに関しても、KPS 70-80% (HR=0.65)、肝転移例 (HR=0.65)、転移数3個超 (HR=0.35)、CA 19-9 59×ULN以上 (HR=0.59) など、事前に規定されたサブグループのほとんどにおいて、nab-P + Gem群はGem群よりも良好であった。
独立評価委員会判定の奏効率は、nab-P + Gem群23%、Gem群7%であり (p=1.1×10-10)、investigator判定の奏効率は、それぞれ29%、8% (p=3.3×10-16) と、いずれもnab-P + Gem群が有意に優れていた。なお、独立評価委員会判定の病勢コントロール率 (奏効 + 16週以上SD) も、nab-P + Gem群48%、Gem群33%と、nab-P群で有意に良好であった (p=7.2×10-6)。
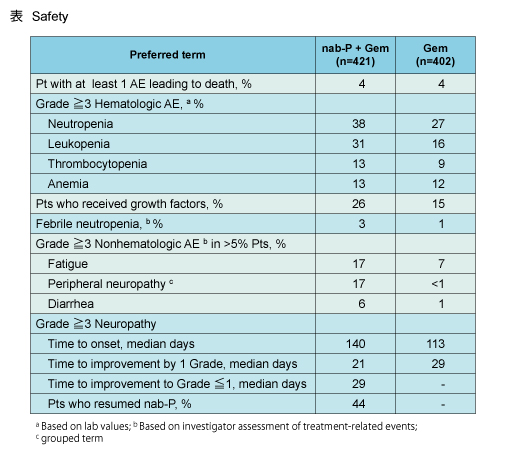
有害事象による死亡は両群とも4%ずつであった (表)。Grade 3以上の血液毒性は好中球数減少が最も高く (nab-P + Gem群38% vs. Gem群27%)、次いで白血球減少 (31% vs. 16%)、貧血 (13% vs. 12%)、血小板数減少 (13% vs. 9%) の順であった。また、grade 3以上の非血液毒性は、疲労 (17% vs. 7%)、末梢神経障害 (17% vs. <1%)、下痢 (6% vs. 1%) が多くみられたが、忍容性は全般的に良好であった。
独立評価委員会判定の奏効率は、nab-P + Gem群23%、Gem群7%であり (p=1.1×10-10)、investigator判定の奏効率は、それぞれ29%、8% (p=3.3×10-16) と、いずれもnab-P + Gem群が有意に優れていた。なお、独立評価委員会判定の病勢コントロール率 (奏効 + 16週以上SD) も、nab-P + Gem群48%、Gem群33%と、nab-P群で有意に良好であった (p=7.2×10-6)。
有害事象による死亡は両群とも4%ずつであった (表)。Grade 3以上の血液毒性は好中球数減少が最も高く (nab-P + Gem群38% vs. Gem群27%)、次いで白血球減少 (31% vs. 16%)、貧血 (13% vs. 12%)、血小板数減少 (13% vs. 9%) の順であった。また、grade 3以上の非血液毒性は、疲労 (17% vs. 7%)、末梢神経障害 (17% vs. <1%)、下痢 (6% vs. 1%) が多くみられたが、忍容性は全般的に良好であった。
nab-P + Gem群のOSはGem群と比べ、6〜24ヵ月のすべての時点において有意に優れていた。また、PFSや奏効率など、有効性に関する評価項目はいずれもnab-P + Gem群で有意に優れ、サブグループ解析でも一貫して良好であった。なお、生命を脅かす重篤な毒性は増加せず、有害事象は許容できるものであり、管理可能であった。
以上より、nab-P + Gem併用療法は、転移を有する膵癌に対する新たな標準治療となり、今後、新たなレジメンの基本となる可能性がある。
以上より、nab-P + Gem併用療法は、転移を有する膵癌に対する新たな標準治療となり、今後、新たなレジメンの基本となる可能性がある。
