|
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内 で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。
|

進行胃癌の1st-line治療におけるS-1 + L-OHPとS-1 + CDDPの無作為化比較第III相試験
Randomized Phase III Study of S-1 plus Oxaliplatin versus S-1 plus Cisplatin for First-line Treatment of Advanced Gastric Cancer
Katsuhiko Higuchi, et al.
L-OHPが胃癌においても有用性を証明

Oxaliplatin (L-OHP) は大腸癌の1st-lineでFOLFOXレジメンやCapeOxレジメンとして国際的にも使用されてきた。胃癌においては英国主体とドイツ主体の臨床試験でCDDPとほぼ同等の効果を発揮することが指摘されており、複数の国で標準的に1st-lineに用いられるようになってきた。
今回の試験は、本邦でのL-OHPの承認試験で、SPとSOXは全く同じといっていいほどのPFS (progression-free survival) を達成している。この結果をもとに、我々の臨床においてもL-OHPが使用できるようになることは、そう遠い先ではないと思われる。
毒性の面では、当初大きな差が出ることを期待されていた食欲不振や悪心・嘔吐においては、副作用マネジメントの技術が上がったことと、AprepitantやPalonosetronといった強力な制吐剤が出てきたためか目立った差になっていない。SPで好中球減少が多いのに比べSOXは軽いことがメリットではあるが、大腸癌でも問題視されている慢性末梢神経障害はこの試験でも高率で、今後の使い分けが大切であろう。しかし、補液を必要としないところは非常に魅力で、早い承認と今回発表されていなかったOS (overall survival) の成績に期待される。
日本では3つの第III相試験 (JCOG9912試験1) 、SPIRITS試験2)、GC0301/TOP-002試験3) ) の結果より、S-1 + CDDP (SP) が進行胃癌の1st-lineにおける標準治療になっている。
現在、日本においてL-OHPは進行胃癌において未承認であるが、S-1 + L-OHP (SOX) レジメンは切除不能進行・再発胃癌における第II相試験で有効性および安全性を示している4) 。この結果はSPIRITS試験におけるSPの有効性と同等であり、腎障害および胃腸障害が少なかった。また、外来患者に対する静注水分補給の必要がなく、より簡便であった。
そこで、標準治療であるSPに対するSOXレジメンの有効性と安全性を検討するため、多施設共同オープンラベル無作為化第III相試験が行われた。
現在、日本においてL-OHPは進行胃癌において未承認であるが、S-1 + L-OHP (SOX) レジメンは切除不能進行・再発胃癌における第II相試験で有効性および安全性を示している4) 。この結果はSPIRITS試験におけるSPの有効性と同等であり、腎障害および胃腸障害が少なかった。また、外来患者に対する静注水分補給の必要がなく、より簡便であった。
そこで、標準治療であるSPに対するSOXレジメンの有効性と安全性を検討するため、多施設共同オープンラベル無作為化第III相試験が行われた。
対象は、測定可能な病変を有し、化学療法および放射線療法による前治療を受けておらず、骨髄、肝、腎などの主要臓器機能が保たれたECOG PS 0-2の切除不能進行・再発胃癌患者であり、S-1 (40mg/m2 bid day1-14) + L-OHP (100mg/m2 day1) を3週毎投与する群 (SOX群) と、S-1 (40mg/m2 bid day1-21) + CDDP (60mg/m2 day8) を5週毎投与する群 (SP群) とに無作為に割り付けた (図1) 。患者背景は両群で同様であり、偏りはみられなかった。
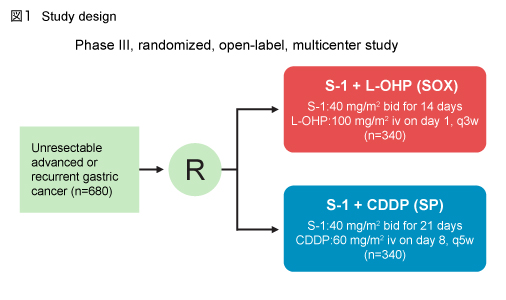
主要評価項目はPFSであり、SPに対する非劣性を検証した。また、他の主要評価項目はOSであり、副次評価項目は奏効率、TTF (time to treatment failure) 、毒性、入院期間であった。
なお、PFS中央値は、SPが6.0ヵ月、SOXが6.5ヵ月、S-1が4.0ヵ月と仮定し、非劣性マージンはPFS中央値5.0ヵ月 (SPとS-1の中央値) 、ハザード比の95% CIの上限を1.30とした。また、片側α=0.025、検出力80%より症例数を両群340例、計680例、1.5年以内のPFSイベントを456件と設定した。
なお、PFS中央値は、SPが6.0ヵ月、SOXが6.5ヵ月、S-1が4.0ヵ月と仮定し、非劣性マージンはPFS中央値5.0ヵ月 (SPとS-1の中央値) 、ハザード比の95% CIの上限を1.30とした。また、片側α=0.025、検出力80%より症例数を両群340例、計680例、1.5年以内のPFSイベントを456件と設定した。
2010年1月〜2011年10月までに685例が登録され、2012年6月に456件のPFSイベントが確認された。なお、有効性の解析は、OSを除きプロトコール適合集団で行われた。
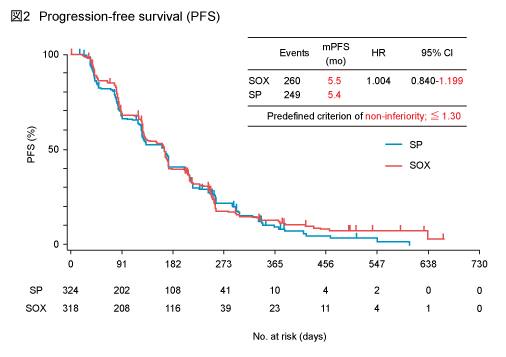
PFS中央値は、SOX群5.5ヵ月、SP群5.4ヵ月であり、SP群に対するSOX群の非劣性を示した (HR=1.004, 95% CI: 0.840-1.199) (図2) 。
治療サイクルの中央値はSOX群7.0サイクル、SP群4.0サイクルであり、相対用量強度の中央値はSOX群78.82%、SP群79.84%であった。また、奏効率はSOX群55.7%、SP群52.2%、病勢コントロール率はSOX群85.2%、SP群81.8%と、SOX群で良好な傾向がみられた。
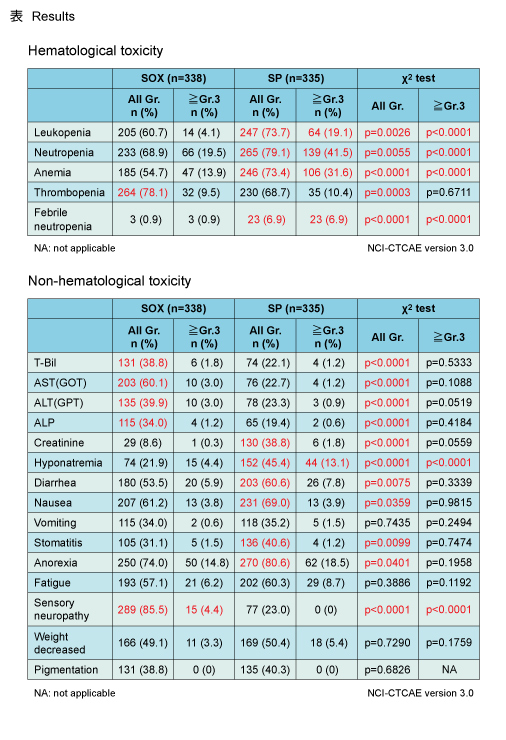
Grade 3以上の有害事象はSOX群71.3%、SP群80.9%と、SOX群で有意に低く (p=0.0035) 、重篤な有害事象もそれぞれ29.3%、37.9%とSOX群で有意に低かった (p=0.0179) 。また、grade 3以上の血液毒性については、白血球減少、好中球減少、貧血、発熱性好中球減少症がSOX群で有意に低かった (各p<0.0001) (表) 。Grade 3以上の非血液毒性については、低ナトリウム血症がSOX群で有意に低く (p<0.0001) 、感覚神経障害がSOX群で有意に高かった (p<0.0001) 。
Grade 3以上の有害事象はSOX群71.3%、SP群80.9%と、SOX群で有意に低く (p=0.0035) 、重篤な有害事象もそれぞれ29.3%、37.9%とSOX群で有意に低かった (p=0.0179) 。また、grade 3以上の血液毒性については、白血球減少、好中球減少、貧血、発熱性好中球減少症がSOX群で有意に低かった (各p<0.0001) (表) 。Grade 3以上の非血液毒性については、低ナトリウム血症がSOX群で有意に低く (p<0.0001) 、感覚神経障害がSOX群で有意に高かった (p<0.0001) 。
主要評価項目であるPFSについてSOX群はSP群に対する非劣性を示した。SOX群は全体的に毒性が低かったが、両群の安全性プロファイルは異なっていた。SOXは静注水分補給や入院の必要がないため、臨床的に簡便である。
以上より、SOXはSPに代わる可能性があり、進行胃癌の1st-lineにおける標準治療の新たな選択肢となると考えられる。なお、OSの最終解析は2013年に完了する予定である。
以上より、SOXはSPに代わる可能性があり、進行胃癌の1st-lineにおける標準治療の新たな選択肢となると考えられる。なお、OSの最終解析は2013年に完了する予定である。
