


治療中に増悪した場合、その治療で使用した薬剤をそのまま次の治療で使用しても効果が期待できるのはCPT-11 (CPT-11後のCPT-11 + 抗EGFR抗体薬) のみであったが、ML18147試験の結果、1st-lineでBevacizumabを使用して増大した場合に、2nd-lineでBevacizumabを継続するとMST (median survival time) が1.4ヵ月有意に延長することが報告された。
本BEBYP試験は当初設定された予定症例 (n=262) に達しない不完全さがあり、生存に関する結果はまだ出ていないものの、ML18147試験の結果が既に報告されているので、positiveとしてとらえることができる。なお、本学会ではML18147試験の年齢別 (65歳以上、未満)、治療レジメン別 (L-OHP、CPT-11ベース)、KRAS status別 (野生型、変異型) のサブグループ解析が報告された1-3)。OS (overall survival) ではL-OHPベース、65歳以上、KRAS 変異型のみ有意差がなかったが、その他のOSやPFS (progression-free survival) はいずれも有意に延長していた。
ML18147試験と本試験を比較すると、ML18147試験が第III相 (n=820)、本試験は無作為化第II相 (n=184)、主要評価項目は前者がOS、本試験はPFSであり、PFSに関するHRは前者0.68、本試験0.65と類似していた。奏効率はML18147試験 (3.9% vs. 5.4%, p=0.3113)、本試験 (18% vs. 21%, p=0.71) と、いずれも有意な上乗せ効果は示せなかった。1st-lineのPFS はML18147試験では9ヵ月以下が55%、9ヵ月超が45%、本試験では中央値10.3ヵ月であり、比較的良好な症例に対してBevacizumabの継続使用が選択肢となると理解してよい。
なお、2nd-lineにおけるBevacizumabと抗EGFR抗体薬の使い分けに関してはBevacizumabとPanitumumabを比較するSPIRITT試験4) と、BevacizumabとCetuximabを比較するACCORD22/PRODIGE18試験5) が行われているので、結果に期待したい。
切除不能進行・再発大腸癌における初回増悪後のBevacizumab (BV) 継続投与に関しては、観察研究 (BRiTE試験、ARIES試験) によって有用性が示唆され6, 7)、2012年 米国臨床腫瘍学会年次集会で報告された第III相試験 (ML18147試験) において生存期間の延長が認められた8)。
BEBYP試験は、切除不能進行・再発大腸癌においてBVを含む1st-line治療後に増悪した患者を対象に、BV継続投与の是非を検討する無作為化比較第III相試験である (図1) 。
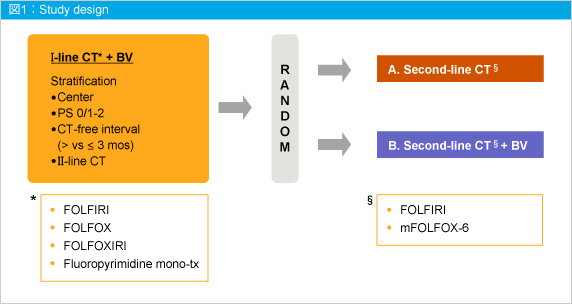
1st-line治療のベースとなった化学療法はFOLFIRI、FOLFOX、FOLFOXIRIおよびフッ化ピリミジン系製剤単独であった。2nd-line治療における化学療法はFOLFIRIまたはmFOLFOX6 とし、化学療法単独 (CT) 群とBV継続投与 (CT + BV) 群とに割り付けられた。なお、BVは5mg/kgを2週間毎に化学療法開始直前に投与した。
本試験にはイタリアの19施設が参加し、イタリア医薬品庁 (AIFA) がサポートした。主要評価項目はPFS (progression-free survival)、副次評価項目は奏効率、OS (overall survival)、安全性、バイオマーカーとした。なお、PFSにおいてHR=0.70、検出率80%、両側検定α=0.05と仮定したところ、249のイベント発生および262例が必要であった。
2008年4月8日から登録が開始されたが、ML18147試験の結果が報告されたことや、BVの供給規制による登録の遅延により2012年5月11日に早期終了した結果、無作為化された患者は185例であった (ITT解析対象184例)。
症例登録基準は大腸腺癌が認められた18〜75歳のECOG PS 0-2で、1st-line治療としてCT + BV治療後または治療中に増悪した症例、またはFOLFOXIRI + BVの最終投与から3ヵ月以上経過した症例とした。
なお、年齢、性別、ECOG PS、病変数、肝限局例、KRAS status、BRAF statusなどの患者背景は、両群に偏りはなかった。
1st-line治療のベースとなった化学療法は、CT群、CT + BV群それぞれ、フッ化ピリミジン系製剤単独 (4%、1%)、FOLFIRI (58%、59%)、FOLFOX (25%、24%)、FOLFOXIRI (13%、16%) であった。また、1st-line治療におけるPFS中央値は両群ともに10.3ヵ月であり、化学療法の休薬が3ヵ月以上あった症例は両群ともに66%、BVの休薬が3ヵ月以上あった症例は、それぞれ43%、50%と、いずれも偏りはなかった。
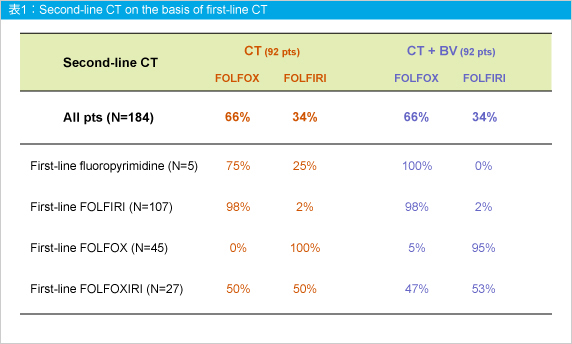
1st-lineおよび2nd-line治療でのレジメン選択は、1st-lineでのFOLFIRI施行例では2nd-lineにおいてFOLFOXが多く使用され、1st-lineでのFOLFOX施行例では2nd-lineにおいてFOLFIRIが多く使用された (表1)。
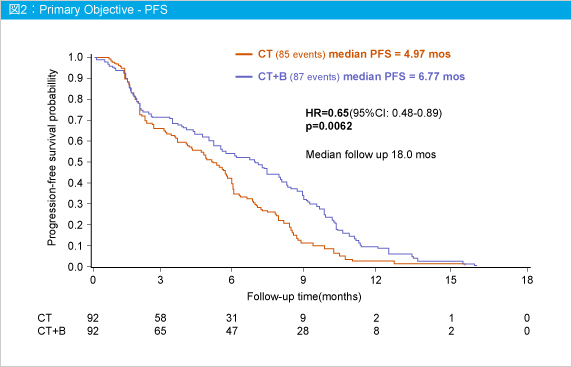
主要評価項目のPFS中央値は、観察期間中央値18.0ヵ月においてCT群4.97ヵ月、CT + BV群6.77ヵ月と、CT + BV群で有意な延長が認められた (HR=0.65, 95%CI: 0.48-0.89, p=0.0062) (図2) 。
患者背景別の解析では、性別、年齢、1st-line治療レジメンなどにおいてPFSの差はみられなかった。奏効率と病勢コントロール率はそれぞれCT群では18%、62%、CT + BV群では21%、71%と、CT + BV群で高い傾向にあったが統計学的有意差は認められなかった。有害事象は、高血圧などVEGF阻害薬で予想される有害事象の発現率がCT + BV群で高かったものの、その他に差はみられず、これまでの報告と変わらなかった。
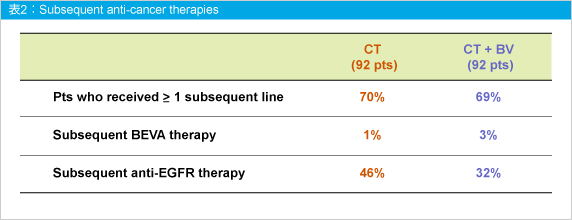
後治療は両群ともに約70%の患者に実施されており、BVを含む治療はCT群で1%、CT + BV群で3%であり、抗EGFR抗体薬による治療はCT群46%、CT + BV群32%に実施されていた (表2)。
BEBYP試験はML18147試験を支持する結果となった。BVによる1st-line治療例における2nd-lineでのBV継続投与は、新しい治療オプションの1つとなることが示された。
1) Bouche O, et al.: ESMO 2012: abst #559P
2) Vieitez JM, et al.: ESMO 2012: abst #565P
3) Österlund P, et al.: ESMO 2012: abst #571P
4) SPIRITT試験 [clinicaltrials.gov]
5) ACCORD22/PRODIGE18試験 [clinicaltrials.gov]
6) Grothey A, J Clin Oncol. 26(33): 5326-5334, 2008 [PubMed][論文紹介]
7) Cohn AL, et al.: 2010 Annual Meeting of the American Society of Clinical Oncology®: abst #3596
8) Arnold D, et al.: 2012 Annual Meeting of the American Society of Clinical Oncology®: abst #CRA3503[学会レポート]
