背景と目的
進行膵癌に対するGemcitabine (GEM) の1st-line治療以降の標準治療は、現時点で確立されていないが、CONKO-3試験において2nd-line治療としての5-FU + L-OHP (OFF) 療法がBSCに比較してPFSおよびOSを有意に延長することが示された1)。今回報告されたPANCREOX試験は、膵癌2nd-line治療におけるmFOLFOX6療法の5-FU持続静注/LV療法に対する有用性を検討するために計画され、カナダで実施されたオープンラベル無作為化第III相試験である。
対象と方法
対象は、GEMを含む化学療法で治療を行った進行膵癌で18歳以上、ECOG PS 0/2の症例である。年齢、性別、ECOG PS、肝転移の有無を層別因子として、mFOLFOX6群と5-FU/LV群に無作為割り付けされ、治療はmFOLFOX6療法もしくは5-FU持続静注/LV療法を病勢増悪になるまで継続された。
主要評価項目はRECISTに基づくPFS、副次評価項目は奏効率、OS、QOL、安全性であった。
結果
目標症例数は128例であったが症例登録が進まず、108例が登録された時点で終了した。患者背景については、進行癌診断からの期間がmFOLFOX6群7.9ヵ月、5-FU/LV群5.7ヵ月とmFOLFOX6群で長い傾向にあったが (p=0.08)、その他の項目において両群に明らかな偏りは認められなかった (表1)。
表1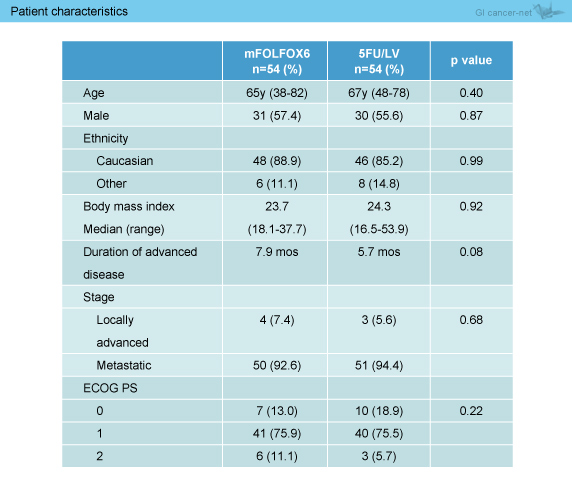
主要評価項目のPFS (ITT解析) の中央値は、mFOLFOX6群3.1ヵ月、5-FU/LV群2.9ヵ月であり、両群に差を認めなかった (HR=1.00, 95% CI: 0.66-1.53, p=0.989) (図1)。
図1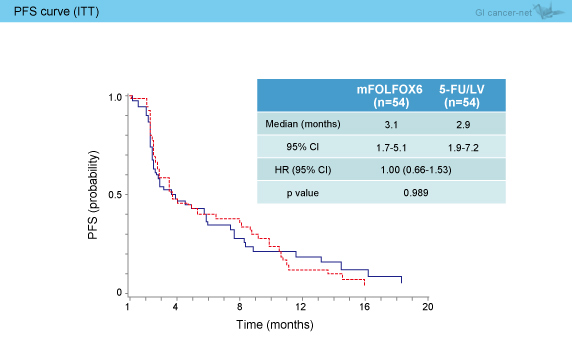
OS中央値は、mFOLFOX6群6.1ヵ月と、5-FU/LV群9.9ヵ月に比べて有意に下回った (HR=1.78, 95% CI: 1.08-2.93, p=0.024) (図2)。
図2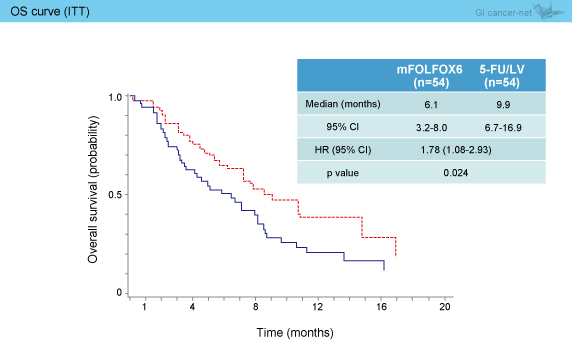
奏効率は、mFOLFOX6群13.2%、5-FU/LV群8.5%と差を認めず (p=0.36)、EORTC-QLQ-C30によるQOL評価でも同様に差は認められなかった (HR=1.37, 95% CI: 0.73-2.57, p=0.33)。
事前に設定されたサブグループ解析では、年齢によってPFSおよびOSに有意な相関が認められ、70歳未満におけるHRは、PFSでは1.37 (95% CI: 0.82-2.30)、OSでは2.86 (95%CI: 1.52-5.40)と、5-FU/LV群で良好な結果であった (図3)。
図3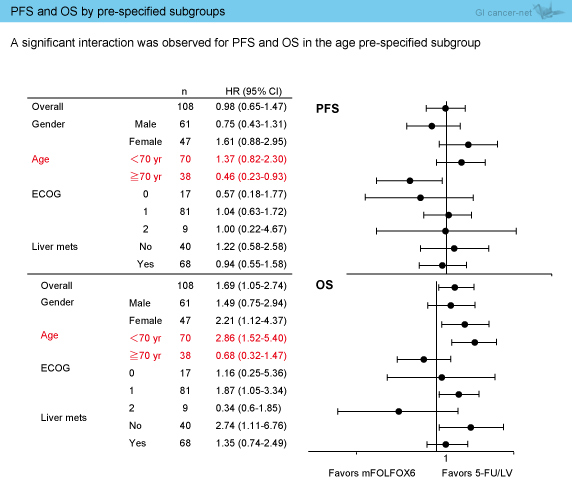
なお、探索的に年齢における検討を行ったところ、70歳未満のECOG PSにおいて両群で大きな偏りが認められ、PS 2の症例はmFOLFOX6群では11.8%に対して、5-FU/LV群は2.9%であった (PSにおける群間p=0.05)。
また、後治療の施行割合は、mFOLFOX6群6.8%、5-FU/LV群23.1%と、5-FU/LV群において有意に高値であった (p=0.015) (表2)。
表2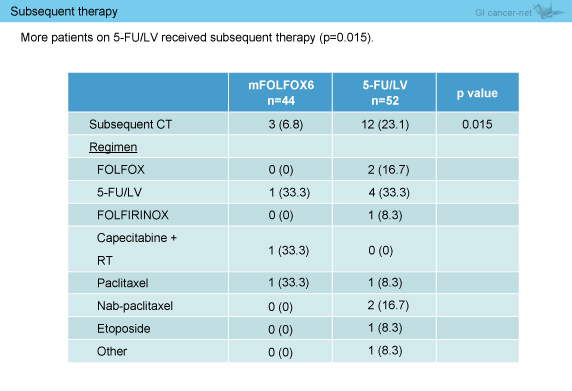
毒性は、L-OHPを加えたmFOLFOX6群で高く、毒性中止はmFOLFOX6群16.3%、5-FU/LV群1.9%であった。Grade 3/4の治療関連有害事象は、好中球減少 (32.7% vs. 3.8%)、疲労 (14.2% vs. 1.9%)、血小板減少 (8.2% vs. 1.9%)、末梢神経障害 (4.1% vs. 0%) などがみられた (表3)。
表3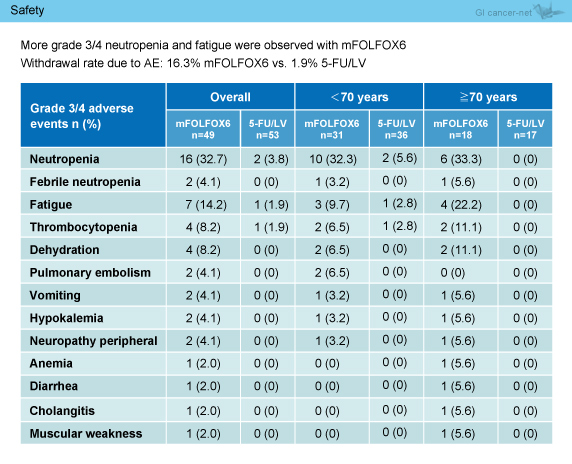
結論
GEM抵抗性となった膵癌の2nd-line治療において、5-FU持続静注/LV療法にL-OHPを加える意義は認められず、PFSは両群で類似しており、OSはmFOLFOX6群で有意に低値であった。OSにおける差の原因としては、後治療の実施割合の違い、70歳未満の若年者における背景の不均一が原因と考えられる。
ACCORD 11試験で示された膵癌初回治療におけるFOLFIRINOX2) の意義や本試験の結果を考慮すると、L-OHP併用化学療法のタイミングは主に1st-line治療となる。
コメント
膵癌では、無作為化試験の結果から2nd-line化学療法の実施が推奨されているが、本邦では、GEM不応症例に対してS-1単剤が選択される。一方、1st-line治療では、無作為化第III相試験においてGEM療法に対する生存の優越性を証明したFOLFIRINOX療法が本邦でも承認された。これよりL-OHPは、膵癌薬物療法のkey drugとしての期待が高まってきていた。しかし、1st-line治療においては、L-OHPのGEMへの上乗せ効果を検証する第III相試験が2つ組まれたものの、結果はいずれも L-OHPの有用性を示すことはなかった3,4)。また、2nd-line治療においては、L-OHPのS-1への上乗せ効果について比較第II相試験が行われたものの、やはり副次評価項目のPFSに差は認められていない5)。そして本発表においても、GEM既治療の膵癌患者に対する2nd-line治療におけるL-OHPの意義が否定された。
先の試験より、2nd-line治療におけるS-1治療群 (PFS2.8ヵ月、MST7.0ヵ月) の結果は、直接今回の試験と比較することはできないが、ほぼ同等と考えられ、GEM治療後の2nd-line治療にはS-1を推奨している本邦のガイドラインには変更の必要はない。本学会においても、1st-line治療としてのFOLFIRINOX療法の有用性が追加報告されていた。今後、GEMあるいはS-1単剤療法からFOLFIRINOX療法へのシフトは進んでいくと考えられるものの、FOLFIRINOX療法は4薬剤の併用療法であり、重篤な副作用の発現が懸念されることから、全身状態が悪いことの多い進行膵癌患者では、適応とならないことも多々ある。したがって、これまで同様に、GEMあるいはS-1単剤による1st-line治療の後治療の開発は必要である。
(レポート:坂井 大介 監修・コメント:佐藤 温)
- Reference


