背景と目的
進行再発膵癌の予後は5年OSで5%以下と極めて不良であり1)、また1st-lineが不応となった後の治療選択が少ないのが現状である。
膵癌の臨床症状として、悪液質、体重減少、倦怠感、血液凝固異常などが知られているが2)、病理学的特徴としても腫瘍には炎症を伴った線維性の間質がみられ3, 4)、膵癌の発病と病状進行には炎症性サイトカインが重要であることが示されている5, 6)。また、膵癌患者の多くは全身性の炎症を伴い、体重減少、筋肉量低下、PS低下の原因となっている7)。
Janus kinase (JAKs) はJAK1、JAK2、JAK3、TYK2を含むキナーゼファミリーであり、STATの転写を活性化させ炎症性サイトカインの調整を行っている。RuxolitinibはJAK1、JAK2阻害剤であり、炎症性サイトカインを阻害し、骨髄線維症において炎症性サイトカインを減少させることにより全身症状とOSを改善することが示されている。Ruxolitinibは、動物実験モデルにおいてCapecitabineとの併用で抗腫瘍効果を示したことから、本試験では膵癌に対するCapecitabine + プラセボを対照とした無作為化二重盲検第II相試験としてCapecitabine + Ruxolitinibの抗腫瘍効果が検証された。なお、C反応性蛋白 (CRP) は全身の炎症を示す指標として感度、特異度に優れ広く用いられており、CRPの上昇は膵癌を含む多くの癌腫で予後不良因子であるため、CRP高値の症例における検討も行われた。
対象と方法
対象は、1st-lineとしてGemcitabineによる治療が行われた後に不応となった膵癌患者であり、Ruxolitinib群 : Capecitabine (1,000mg/m2, 1日2回 day1-14) + Ruxolitinib (15mg, 1日2回 day1-21) と、プラセボ群 : Capecitabine (1,000mg/m2, 1日2回 day1-14) + プラセボ (1日2回 day1-21) に無作為に割り付けられた (図1)。
主要評価項目はOSであり、副次評価項目は臨床症状の改善 (疼痛、Karnofsky PS、鎮痛剤の使用、体重減少)、奏効率 (RECIST)、4週間後の効果の確定、PFS、QOL、安全性であった。なお、炎症に対する仮説を証明するために、CRP、アルブミン値、PSによるサブグループ解析が事前に計画された。
図1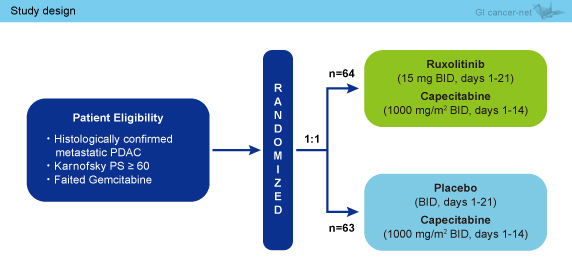
結果
両群の臨床病理学的背景に有意な差は認めなかった (表1)。
表1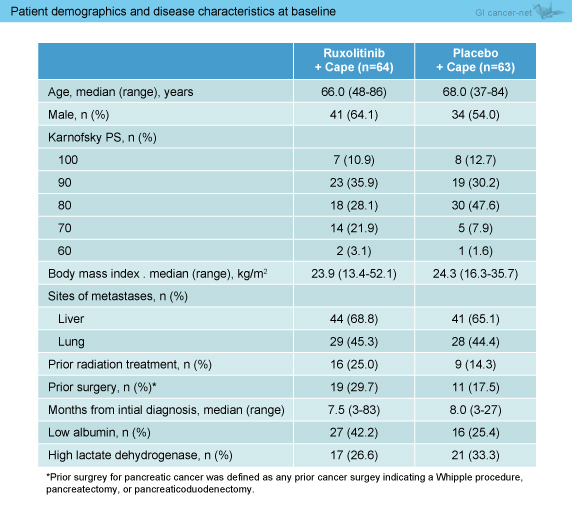
OS (ITT) の検討では、Ruxolitinib群がプラセボ群に対して良好な傾向がみられたものの、有意差は認めなかった (HR=0.79, 95% CI: 0.53-1.18, p=0.25) (図2)。
図2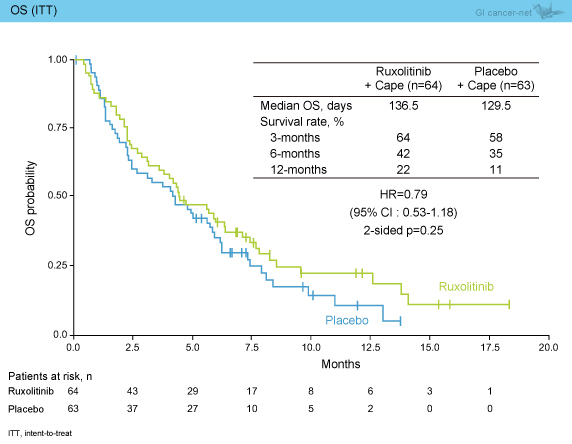
事前に計画されたCRP>13mg/Lのサブグループ解析では、Ruxolitinib群で有意にOSを延長した (HR=0.47, 95% CI: 0.26-0.85, p=0.01) (図3)。
図3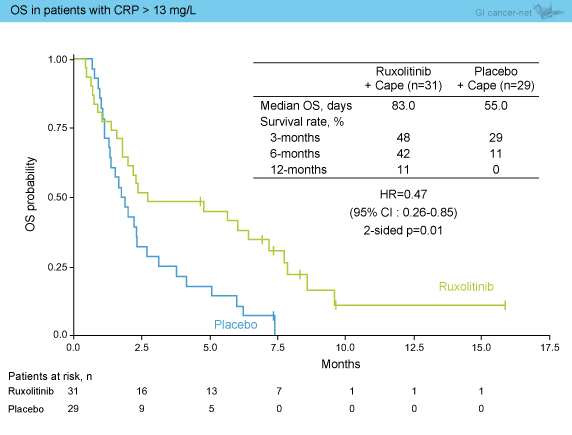
PFSの検討では、ITT解析 (HR=0.75, 95% CI: 0.51-1.10, p=0.14) 、CRP>13mg/L (HR=0.62, 95% CI: 0.35-1.10, p=0.10) ともRuxolitinib群が良好な傾向にあったが、統計学的に有意な差は認めなかった。Waterfall plotではRuxolitinib群において腫瘍縮小が得られた症例が多くみえるものの (図4)、奏効率、病勢コントロール率 (CR + PR + SD) は、両群に差を認めなかった。
図4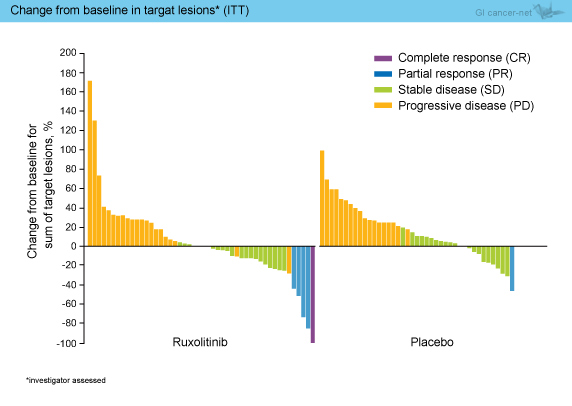
また、臨床症状の比較の1つとして体重増加が検討され、ITT全体およびCRP>13mg/L、CRP≦13mg/Lのいずれの場合においてもRuxolitinib群において体重増加を認めた症例が多かった。
有害事象については、貧血のみRuxolitinib群で多い傾向がみられたが、それ以外の全gradeの発現率、grade 3以上の発現率、有害事象による治療中止はいずれもRuxolitinib群で少なかった (表2)。
表2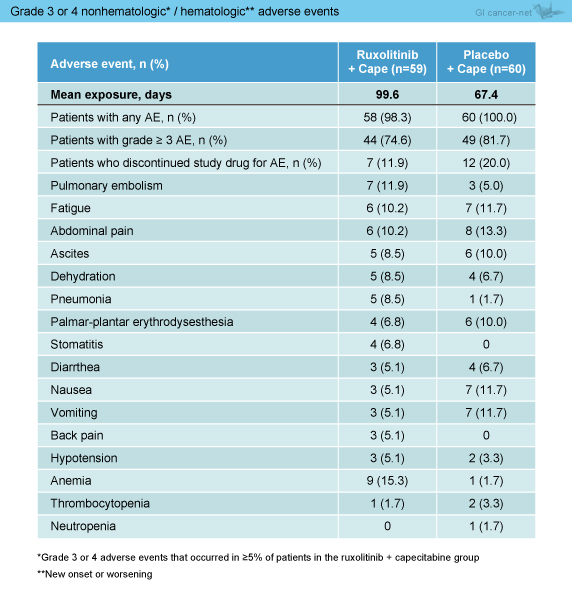
結論
JAK1 / JAK2阻害剤であるRuxolitinibは、Capecitabineとの併用で進行再発膵癌の2nd-lineにおいて臨床的な効果を示し、忍容性は高かった。これらの結果により、進行再発膵癌における炎症の役割と、JAK-STAT系が新しい治療対象となることが明らかになった。
なお、現在膵癌に対する第III相試験への患者組み入れが始まっており8, 9)、他の固形癌においても臨床試験を開始している10-12)。
コメント
Ruxolitinibの膵癌に対する抗腫瘍効果を検証した初めての第III相試験である。炎症性サイトカインが膵癌の進展に関与していることを裏付ける結果と言える。また、従来の抗腫瘍薬と異なり、Ruxolitinib併用群には副作用の軽減と体重の増加が得られている。
膵癌を含めた消化器癌患者の多くに体重減少が認められ、体重減少を認める消化器癌症例は予後が不良で、QOLやPSも不良であることが報告されている13)。さらに、QOLの悪化はQALYs (質調整生存年) を短縮させるので、化学療法を含めた医療行為全体の価値を低下させる。したがって、消化器癌患者の体重を増加させることは、QOLの改善とともに医療行為の価値を高めることにつながる。
化学療法と除脂肪体重との関係について、いくつかの報告がある。Mayo regimenによる術後補助化学療法を施行した大腸癌患者を対象とした検討では、有害事象を認めた群では除脂肪体重あたりの5-FU投与量が有意に大きかった14)。さらに、転移を有した他剤耐性の乳癌にCapecitabineを投与して行われた検討では、サルコペニア症例では非サルコペニア症例と比較して用量制限毒性の発現頻度が2.5倍であった15)。本研究では、Ruxolitinib併用群でCapecitabineのコンプライアンスが高まっており、Ruxolitinibによる炎症性サイトカインの作用のブロックと、体重の維持・増加に伴う除脂肪体重の維持・増加の双方によってもたらされた結果と考えられる。
癌の進行、とりわけ悪液質の進展には炎症性サイトカインが深く関与している16)。Ruxolitinibは、消化器癌患者の終末期近辺のQOLを改善する可能性をも秘めているといえる。
(レポート:中村 将人 監修・コメント:大村 健二)
- Reference
-
- 1) NCCN guideline Pancreatic Adenocarcinoma v.1.2014
- 2) Hidalgo M: N Engl J Med. 362(17): 1605-1617, 2010[PubMed]
- 3) Chu GC, et al.: J Cell Biochem. 101(4): 887-907, 2007[PubMed]
- 4) Mahadevan D, et al.: Mol Cancer Ther. 6(4): 1186-1197, 2007[PubMed]
- 5) Fukuda A, et al.: Cancer Cell. 19(4): 441-455, 2011[PubMed]
- 6) Lesina M, et al.: Cancer Cell. 19(4): 456-469, 2011[PubMed]
- 7) Fearon KC, et al.: World J Surg. 23(6): 584-588, 1999[PubMed]
- 8) Clinical Trials.gov: Study of Ruxolitinib in Pancreatic Cancer Patients (Janus 1)
- 9) Clinical Trials.gov: A Study of Ruxolitinib in Pancreatic Cancer Patients
- 10) Clinical Trials.gov: Study of Ruxolitinib in Colorectal Cancer Patients
- 11) Clinical Trials.gov: Ruxolitinib in Combination With Pemetrexed/Cisplatin in Non Small Cell Lung Cancer
- 12) Clinical Trials.gov: A Study of Ruxolitinib in Combination With Capecitabine in Subjects With Advanced or Metastatic HER2-negative Breast Cancer
- 13) Andreyev HJ, et al.: Eur J Cancer. 34(4): 503-509, 1998[PubMed]
- 14) Prado CM, et al.: Clin Cancer Res. 13(11): 3264-3268, 2007[PubMed]
- 15) Prado CM, et al.: Clin Cancer Res. 15(8): 2920-2926, 2009[PubMed]
- 16) Lucia S, et al.: Crit Rev Oncog. 17(3): 315-321, 2012[PubMed]


