背景と目的
Bevacizumab (Bev) 併用療法は切除不能進行・再発大腸癌に対する標準治療の1つとして位置付けされており1, 2)、プラットフォームとなるFOLFIRI療法とFOLFOX療法の治療効果は同等であることがV308試験において示されている3)。しかし、これらのプラットフォームレジメンは、Bev併用における比較検討がなされていないため、mFOLFOX6 + Bev療法に対するFOLFIRI + Bev療法の効果を検証する試験を計画した。
対象と方法
オープンラベル無作為化第III相試験として、前治療歴のない切除不能進行・再発大腸癌症例 (組織学的診断、20?75歳、ECOG PS 0/1) が、mFOLFOX6 + Bev群 (mFOLFOX6:L-OHP 85mg/m2, l-Leucovorin 200mg/m2, 5-FU急速静注 400mg/m2, 5-FU持続静注 2,400mg/m2 + Bev 5mg/kg; 2週毎)、またはFOLFIRI + Bev群 (FOLFIRI:CPT-11 150mg/m2, l-Leucovorin 200mg/m2, 5-FU急速静注 400mg/m2, 5-FU持続静注 2,400mg/m2 + Bev 5mg/kg; 2週毎) に割り付けられた (層別化因子:施設、術後補助化学療法歴、肝限局転移)。
主要評価項目はPFSで、PFS中央値をmFOLFOX6 + Bev群10ヵ月、FOLFIRI + Bev群11ヵ月と仮定し (HR=0.900)、FOLFIRI + Bev群のmFOLFOX6 + Bev群に対する非劣性マージンを1.25として検証した。片側α=2.5%、検出力85%により、必要症例数は400例となり、非劣性が示された場合、FOLFIRI群の優越性も検証する計画とした。
また、副次評価項目は、OS、TTF (time to treatment failure)、奏効率 (RECIST v1.0)、治療後切除率、安全性 (CTCAE v3.0)、QOL (FACT-C, FACT/GOG-Ntx) であった。
結果
2008年9月から2012年6月までに402症例が登録され、FAS (full analysis set) 解析として、mFOLFOX6 + Bev群198例、FOLFIRI + Bev群197例が解析された (図1)(表1)。
図1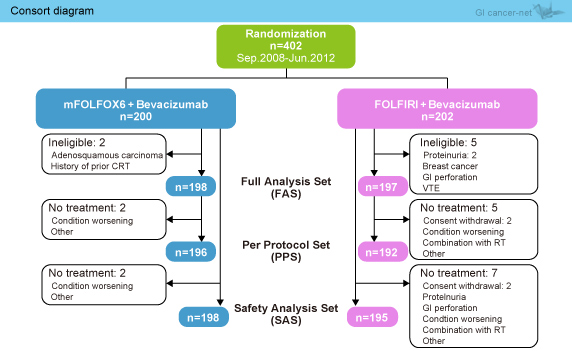
表1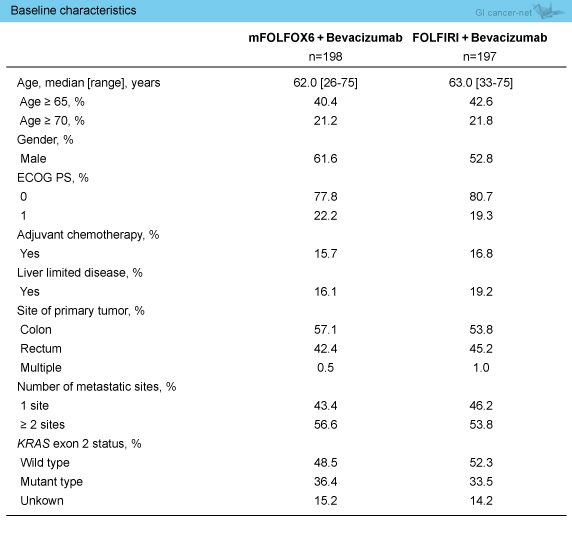
追跡期間中央値はmFOLFOX6 + Bev群32.5ヵ月、FOLFIRI + Bev群29.3ヵ月であった。
PFS中央値は、mFOLFOX6 + Bev群10.7ヵ月、FOLFIRI + Bev群12.0ヵ月であり、非劣性が示された (HR=0.905, 95% CI: 0.723-1.133, 非劣性p=0.003) (図2)。
図2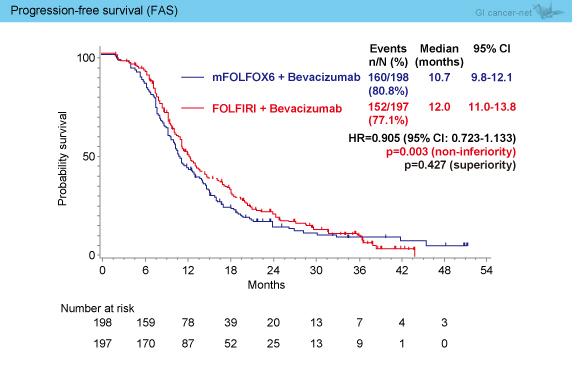
OS中央値は、mFOLFOX6 + Bev群28.9ヵ月、FOLFIRI + Bev群31.8ヵ月であった (HR=0.901, 95% CI: 0.683-1.189, p=0.376) (図3)。
図3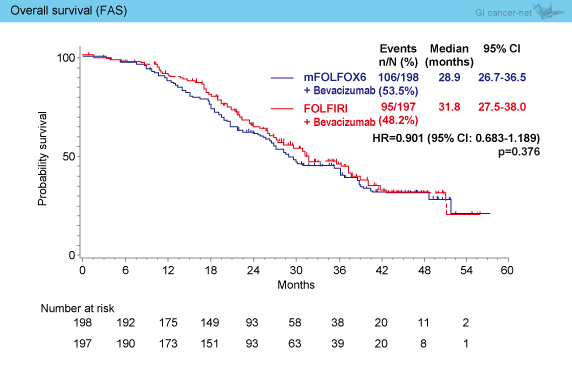
PPS (per protocol set) 解析例における奏効率は、mFOLFOX6 + Bev群62.2%、FOLFIRI + Bev群63.8% (p=0.757)、TTF中央値はそれぞれ7.3ヵ月、8.5ヵ月と両群に差はなかった (p=0.150) 。また、FAS解析におけるR0切除率にも差を認めなかった (9.1% vs. 10.2%, p=0.736)。 後治療は、mFOLFOX6 + Bev群で約85%、FOLFIRI + Bev群で約80%の症例で行われ、内訳はフッ化ピリミジン系製剤80.8% vs. 78.7%、CPT-11 62.1% vs. 46.7%、L-OHP 37.4% vs. 62.9%、Bev 54.5% vs. 52.3%、抗EGFR抗体薬29.8% vs. 28.9%であった。
治療中止は、mFOLFOX6 + Bev群で192例、FOLFIRI + Bev群で182例に認め、有害事象による中止はそれぞれ19.8%、18.1%であった。主な有害事象は表2のとおりである。
表2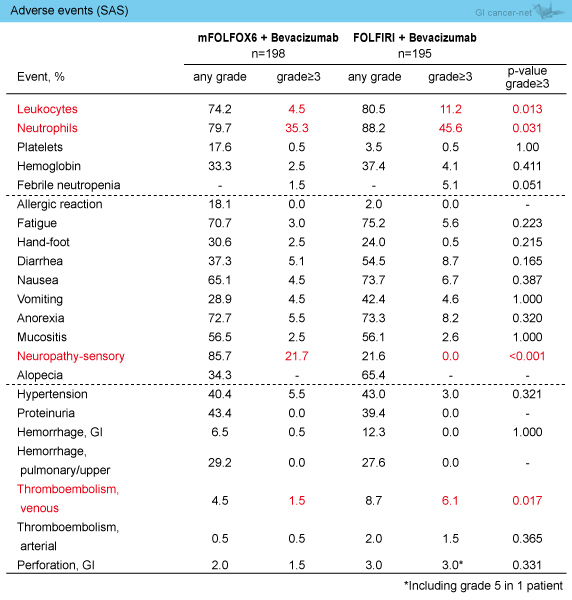
また、両群で毒性は許容範囲内であり、QOL評価ではmFOLFOX6 + Bev群に比べてFOLFIRI + Bev群で良好であった (図4)。
図4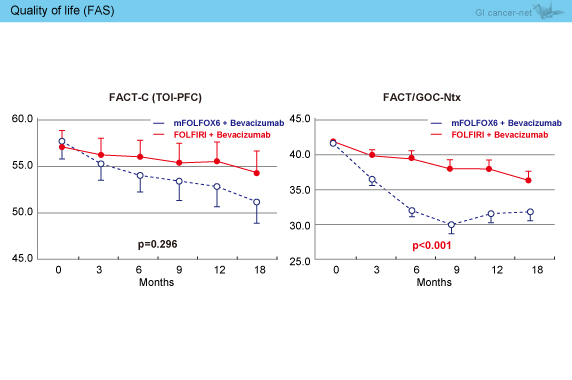
結論
切除不能進行・再発大腸癌の1st-lineとして、PFSにおけるmFOLFOX6 + Bev療法に対するFOLFIRI + Bev療法の非劣性が示された。また、OS、QOLもFOLFIRI + Bev療法群において良好な結果であった。
コメント
本邦で実施されたA群「mFOLFOX6 + Bev療法」に対するB群「FOLFIRI + Bev療法」の非劣性を検証する第III相試験であり、400例という症例数をもって見事にその非劣性が証明された。時代背景は異なるが、有名なV308試験3) と比較すると、本試験はPFSでA群は10.7ヵ月、B群で12.0ヵ月と、V308試験でのFOLFOX、FOLFIRIの8ヵ月、8.5ヵ月に対してBevの上乗せ分の生存期間の延長が認められた。さらにOSにおいては、V308試験の両群ともに約20ヵ月の時代に比し、A群28.9ヵ月、B群31.8ヵ月と確実に延長しており、現在の進行大腸癌治療のOSが30ヵ月を越えんとする時代となったことを実感させるデータであった。
また本邦においては、V308試験が報告された後も、CPT-11の毒性を嫌がってか、FOLFOXを先行させることが多かったが、本試験のQOL解析により、FOLFIRI + BevレジメンでQOLが良好な傾向がみられ、かつ効果も同等であることからも、1st-line治療としてのFOLFIRI療法を検討する良い機会になったと言える。ディスカッサントは軽く流してしまい残念であったが、本試験は両標準治療の直接比較の第III相試験としてはおそらく世界で最初の試験であり、両者の非劣性証明に関しては予測どおりの結果とはいえ、それを実際に第III相試験で検証し得たことは価値があると言えると思われる。
(レポート:砂川 優 監修・コメント:小松 嘉人)
- Reference


