CPT-11 + Panitumumab
 |
||||||||||||||||
|
||||||||||||||||
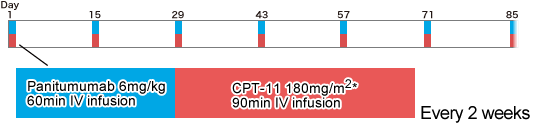
Chibaudel B, et al.: ASCO 2011: abst #3573 |
Panitumumabは、米国アムジェン社(旧Abgenix 社、Immunex社)がXenomouse®技術を用いて開発した高親和性のIgG2 サブクラスのヒト型モノクローナル抗体である。PanitumumabはEGFR に結合し、内在性リガンドのEGFR への結合と、その後に続くEGFR を介したシグナル伝達を阻害することで、腫瘍の増殖を抑制すると考えられている。
欧米では、2006年9月(米国)および2007年12月(EU)で承認された。本邦においては、2010年4月「KRAS 遺伝子野生型の治癒切除不能な進行・再発の結腸・直腸癌」を対象に、一次治療、二次治療、三次治療以降の治療薬として承認された。
◆GERCOR試験
フランスの臨床試験グループGERCORは、5-FU、L-OHPならびにCPT-11の治療後に病勢進行が認められたKRAS 遺伝子野生型の切除不能進行再発大腸癌を対象に、3rd-lineとしてのCPT-11 + Panitumumabの有効性・安全性を検討する第II相試験を行った。Panitumumab 6mg/kgとCPT-11 180mg/m2は2週に1回の間隔で投与された(PIMABI)。
■有効性
主要評価項目である奏効率は32.8%、progression-free survival(PFS) およびoverall survival(OS) の中央値はそれぞれ6.0ヵ月、14.5ヵ月であった1)。
本試験は単アームの評価であるが、2nd-lineとしてのPanitumumabの第III相試験である20050181試験の FOLFIRI + Panitumumab群の成績と比較しても同程度の有効性が得られており(奏効率: 35%, PFS: 5.9ヵ月, OS: 14.5ヵ月2))、CPT-11不応後の症例に対しても有用性が期待されるレジメンである。
■安全性
61例中3例が用量制限毒性のために治療を中止したが、治療関連死はみられなかった1)。頻度の高いGrade 3/4の有害事象はざ瘡様皮疹(18.0%)、下痢(14.8%)、好中球数減少(11.5%) であった(下表参照)。なお、Infusion reactionはみられなかった。
Reference
- 1) Chibaudel B, et al.: ASCO 2011: abst #3573[ASCO abstracts][ASCO 2011レポート]
- 2) Peeters M, et al.: J Clin Oncol. 28(31): 4706-4713, 2010[PubMed]
- 副作用対策講座「皮膚障害-1 分子標的薬の皮膚障害」
- 副作用対策講座「悪心・嘔吐」
- 副作用対策講座「下痢」
- ESMO 2011#6144[ESMO 2011レポート]
GI cancer-net
消化器癌治療の広場
