|
|
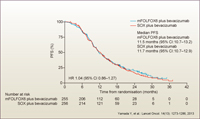
PFS中央値は、mFOLFOX6群11.5ヵ月、SOX群11.7ヵ月、ハザード比1.04 (95% CI: 0.86-1.27) であり、ハザード比の信頼区間の上限1.27が非劣性マージン1.33を下回ったため、SOX群のmFOLFOX6群に対する非劣性が示されました (図3)。過去の臨床試験との比較可能性を持たせるために、RECISTによるPFSを採用した場合の非劣性検証も行われており、中央値は両群いずれも10.2ヵ月でした (HR=1.02, 95% CI: 0.85-1.23)。10.2ヵ月という値は海外の多くの臨床試験で示されているPFS中央値と類似しますので、この試験の結果は、海外の臨床試験との比較可能性もあると思います。
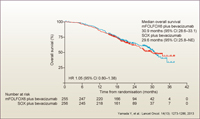
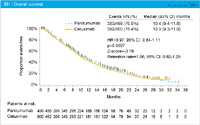
OSはまだcensored caseが多くみられますが、16ヵ月あたりまでは追跡されており、両群に差はみられませんでした (HR=1.05, 95% CI: 0.80-1.38) (図4)。なお、L-OHPの用量強度がmFOLFOX6群62.7%、SOX群75.5%と、mFOLFOX6群で低くなっていますが、影響は少ないと考えています。
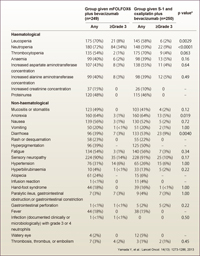
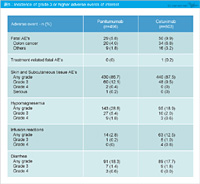
有害事象は、mFOLFOX6群の方で血液毒性がやや強く、特にgrade 3の好中球減少はmFOLFOX6群34%、SOX群9%と有意に高くなっています (p<0.0001) (表1)。一方、SOX群ではgrade 3の下痢の発現頻度が有意に高かったものの (3% vs. 9%, p=0.0040)、許容範囲内と考えられました。
坂本:ありがとうございます。山中先生はSOFT試験についてどうお考えでしょうか。
山中:日本で行われた大規模な第III相試験で、対照群の成績は海外と同等であり、評価されるべき試験だと思います。OSの評価がまだ定まっていないので、今後のフォローアップに期待したいと思います。
坂本:進行再発癌においては2nd-line、3rd-lineの影響も無視できないため、非劣性試験の主要評価項目はOSにすべきという考え方もあると思いますが、なぜ主要評価項目がPFSとなったのでしょうか。
市川:結果が早く出ることや、症例数の実現可能性の問題もあるのだと思います。
坂本:市川先生は臨床的にどう解釈されましたか。
市川:主要評価項目に関してKaplan-Meier曲線が重なり非劣性を示しており、一方で毒性プロファイルは異なっているので、両レジメンともに今後の選択肢になり得るという、解釈のしやすい試験だと思います。
 仮想プラセボの考え方に基づく非劣性試験
仮想プラセボの考え方に基づく非劣性試験
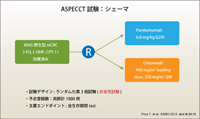
山中:ASPECCT試験は、5-FU、L-OHP、CPT-11の治療歴を持つKRAS野生型の切除不能進行・再発大腸癌を対象に、PanitumumabのCetuximabに対する非劣性を検討した第III相試験です (図5) 6)。計1,000例を予定登録数として世界中から登録されました。
ASPECCT試験が実施された背景には、3rd-lineを対象にした2つの試験があります。CetuximabのBSCに対する優越性を検討したNCIC CTG CO.17試験では、主要評価項目であるOSで有意差を認めましたが (HR=0.55, p<0.001) 7)、同様にPanitumumabのBSCに対する優越性を検討した20020408試験では、主要評価項目のPFSで有意差を認めましが (HR=0.54, p<0.0001) OSでは有意差を認めませんでした (HR=1.00, p=0.81) 8)。この違いは、NCIC CTG CO.17試験ではBSC群におけるCetuximabへのクロスオーバーを禁止していたのに対し、20020408試験ではPanitumumabへのクロスオーバーを許容したことが原因です。BSC群の実に約8割にPanitumumabが投与されており、結果的にPanitumumab同士の比較に近い状態になったため、OSに差が出ませんでした。EMAは20020408試験を根拠にPanitumumabを条件付き承認 (conditional approval) しましたが、一方で、PanitumumabのBSCに対するOSの延長効果を厳密に評価することを課題とし、このASPECCT試験が実施されました。
ASPECCT試験は、仮想プラセボの考え方に基づいています。NCIC CTG CO.17試験におけるCetuximabのBSCに対する効果をM1と設定し、Panitumumab がM1の50%以上を維持しているか (維持率50%以上) を検証することを目的としたデザインです。
主要評価項目OSのハザード比は0.97でした (図6)。Panitumumab群の方がやや上回っていることを反映して、M1の維持率は106% (95% CI: 82-129%) となり、100%を超えました。信頼区間の下限も82%ですので、50%を超えています。以上の結果から、PanitumumabのBSCに対するOSの有効性が示され、EMAから課せられた上述の課題もクリアしました。併せてCetuximabに対する非劣性も示されています。
坂本: ありがとうございました。市川先生はどう解釈されましたか。
市川: 統計的に2群の有効性と安全性は等しいと言い切ってよろしいでしょうか?
山中:単剤の比較というピュアな設定です。さらに、ハザード比の信頼区間を見ますと、区間幅が狭く、上限が1.11、下限が0.84ですので、1.00に近い値です。実質的に2剤の有効性は同じであるとみなしていいと思います。
市川:3rd-line以降でCetuximabとPanitumumabの効果、特にOSに関しては同様であり、有害事象においても差はないというのが試験の解釈で、臨床的にはケースに応じて使いやすい薬剤を使うということになると思います。分析感度や用量強度がまだ公表されていないので、それらが発表されると臨床的な重みがさらに増すでしょう。
坂本:ASPECCT試験では非劣性マージンが設定されていませんが、問題ないのですよね?
山中:はい。「CetuximabのBSCに対する効果 (M1) の50%を維持する」という考え方はそのままにして、固定マージンを設定する方法も採用できたと思います。しかし、ASPECCT試験ではより高い検出力が得られる統合法 (synthesis method) が用いられています。先に少し触れましたが、統合法では一定値の固定マージンを設定しないので、固定マージン法に比べると少々わかりづらいのですが、FDAガイダンスで示されている方法です。
坂本:事前に作成される統計解析の手順書には、統合法を用いて維持率を50%に設定することは記載されているのでしょうか。
山中:SOFT試験では1.33という固定マージンが設定されていました。これと同様に、ASPECCT試験では維持率を50%とすることは事前に規定されていました。ASPECCT試験は仮想プラセボという考え方について再認識させてくれる質の高い試験だと思います。
市川:これまで癌領域で統合法を用いた試験はあるのでしょうか。

山中:仮想プラセボの考え方に基づいてデザインされた非劣性試験は、私の知る限り、大腸癌領域ではNO16966試験4)だけだと思います。ただし、先ほど説明したように、NO16966試験は固定マージンを設定しています。仮想プラセボの考え方かつ統合法を用いたのはASPECCT試験が初めてだと思います。
市川:臨床家もこのような非劣性試験があるということを知っておく必要がありますね。
坂本:そうですね。これまで非劣性試験において固定マージンの設定は常に問題となってきましたが、仮想プラセボに基づいた統合法も今後用いられていくかもしれません。臨床家の先生も非劣性試験について学んでいく必要があるでしょう。市川先生、山中先生、本日は貴重なご意見をいただきまして、ありがとうございました。
 |