ESMO 2014 Congress
肝細胞癌
Abstract #LBA16
1st-lineにおいてSorafenibを投与した進行肝細胞癌に対する2nd-lineとしてのRamucirumab:無作為化第III相試験 (REACH試験)
Ramucirumab as Second-line Treatment in Patients with Advanced Hepatocellular Carcinoma Following First-line Therapy with Sorafenib: Results from the Randomized Phase III REACH Study
Andrew X. Zhu, et al.

Expert's view

仁科 智裕 先生
国立病院機構
四国がんセンター
消化器内科
PFSでは有意に生存を改善し (HR=0.625)、ほとんどのサブグループで有用性がみられており、Ramucirumabは肝細胞癌に対して薬効があることは間違いない。しかし、OSではHR=0.866とPFSのベネフィットがそのまま反映されない結果となった。VEGF経路を標的とする低分子化合物であるBrivanib1) やAxitinibにおいても本試験と同様の対象で第III相試験が行われたが、TTPやPFSでは有意差が認められた一方、OSでは良好な結果ではあるものの、やはり有意差が認められていない。副作用については腹水、血小板減少、肝障害/肝不全、肝性脳症がRamucirumab群で有意に多く、肝細胞癌に併存する肝炎等による背景肝の機能低下により、全身化学療法 (特に2nd-line) の困難さを示唆しているものと思われる。
本試験のサブ解析では、AFP高値 (400ng/mL以上) の症例において有意なOSの延長を認めている。また、前述のBrivanibにおいてはAFP低値 (200ng/mL未満) の症例、Axitinibにおいてはアジア人でより良好な成績がでている。肝細胞癌に対する全身化学療法開発においては、背景肝の状態を考慮することに加え、多くの分子異常が報告されるなど多様性を持つ腫瘍であることから、腫瘍の状態やバイオマーカー等で対象を絞り込んでいくことが重要になってくると思われる。
肝細胞癌に対する1st-line治療としてはSorafenibが使用されているが2, 3)、2nd-lineにおいて生存ベネフィットが確立された治療法は存在しない1, 4)。一方で、肝細胞癌の増殖にはVEGFおよびVEGFR-2を介したシグナルが関与することが知られ、これらが治療標的になり得ると考えられている。Ramucirumab (RAM) はVEGFR-2に対するヒト型IgG1抗体薬であり、未治療の肝細胞癌患者に対する単群第II相試験において抗腫瘍活性が示されている5)。今回、Sorafenibによる1st-lineが行われた進行肝細胞癌患者に対する2nd-lineとしてのRAMの有効性と安全性を評価する無作為化第III相試験 (REACH試験) が実施された。
対象は、Sorafenibによる治療歴があり、Child-Pugh分類A、EGOG PS 0/1で、BCLC stage Cもしくはstage Bのうち局所治療の施行不能/無効な病変を有する肝細胞癌患者であり、RAM (8mg/kg, 2週毎) + BSC (best supportive care) を行う群 (RAM群) とプラセボ + BSCを行う群 (プラセボ群) に1:1で無作為に割り付けた (図1)。主要評価項目はOS、副次評価項目はPFS、TTP (time to progression)、奏効率、安全性、PRO (patient-reported outcome) であった。OS中央値がプラセボ群8ヵ月、RAM群10.67ヵ月 (HR=0.75) と仮定し、検出力85%、両側α=0.05で、必要症例数は544例であった。
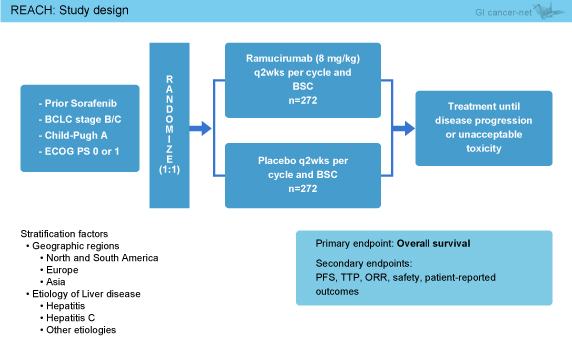
図1

565例が対象となり、RAM群283例、プラセボ群282例に無作為に割り付けられた。ベースライン時の患者背景は両群で同様であり、相対用量強度はRAM群98.5%、プラセボ群99.0%といずれも良好であった。
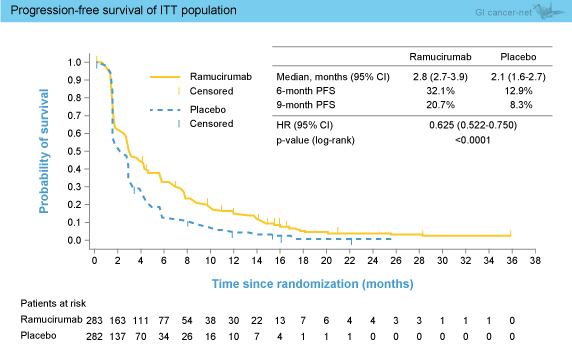
OS中央値はRAM群9.2ヵ月、プラセボ群7.6ヵ月であり、有意差は認めなかった (HR=0.866, 95% CI: 0.717-1.046, p=0.1391) (図2)。なお、ベースライン時のAFPが400ng/mL以上であった症例 (250例) におけるOS中央値はRAM群7.8ヵ月、プラセボ群4.2ヵ月とRAM群で有意な延長を認めたが (HR=0.674, 95% CI: 0.508-0.895, p=0.0059)、AFPが400ng/mL未満の症例では両群間に差はみられなかった (HR=1.093, 95% CI: 0.836-1.428, p=0.5059)。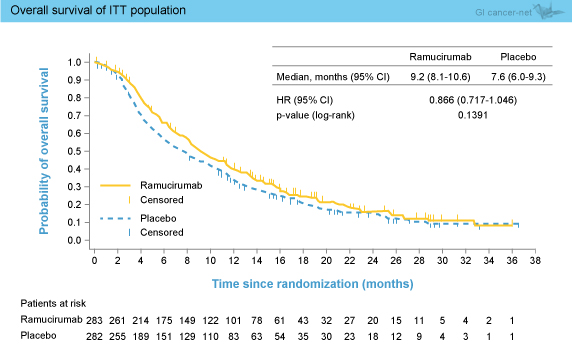 PFS中央値はRAM群2.8ヵ月、プラセボ群2.1ヵ月とRAM群で有意な延長を認め (HR=0.625, 95% CI: 0.522-0.750, p<0.0001) (図3)、サブグループ解析においてもECOG PS 1を除くすべてのサブグループにおいて有意な改善を認めた。また、TTP (中央値3.5 vs. 2.6ヵ月, HR=0.593, 95% CI: 0.487-0.722, p<0.0001)、奏効率 (7.1 vs. 0.7%, p<0.0001) のいずれもRAM群で有意に良好であった。
PFS中央値はRAM群2.8ヵ月、プラセボ群2.1ヵ月とRAM群で有意な延長を認め (HR=0.625, 95% CI: 0.522-0.750, p<0.0001) (図3)、サブグループ解析においてもECOG PS 1を除くすべてのサブグループにおいて有意な改善を認めた。また、TTP (中央値3.5 vs. 2.6ヵ月, HR=0.593, 95% CI: 0.487-0.722, p<0.0001)、奏効率 (7.1 vs. 0.7%, p<0.0001) のいずれもRAM群で有意に良好であった。
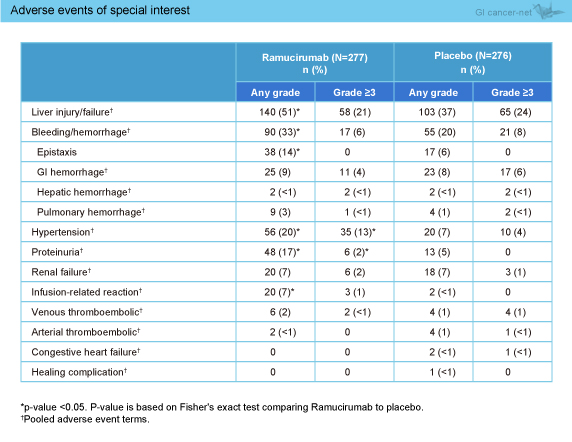
 Grade 3以上の有害事象としては、高血圧、腹水、血小板減少、肝性脳症、好中球減少がRAM群で高い傾向にあった。また、特に注目すべき有害事象として、肝障害/肝不全、鼻出血、高血圧、蛋白尿、infusion-related reactionがRAM群で有意に多く認められた (表)。
Grade 3以上の有害事象としては、高血圧、腹水、血小板減少、肝性脳症、好中球減少がRAM群で高い傾向にあった。また、特に注目すべき有害事象として、肝障害/肝不全、鼻出血、高血圧、蛋白尿、infusion-related reactionがRAM群で有意に多く認められた (表)。
OS中央値はRAM群9.2ヵ月、プラセボ群7.6ヵ月であり、有意差は認めなかった (HR=0.866, 95% CI: 0.717-1.046, p=0.1391) (図2)。なお、ベースライン時のAFPが400ng/mL以上であった症例 (250例) におけるOS中央値はRAM群7.8ヵ月、プラセボ群4.2ヵ月とRAM群で有意な延長を認めたが (HR=0.674, 95% CI: 0.508-0.895, p=0.0059)、AFPが400ng/mL未満の症例では両群間に差はみられなかった (HR=1.093, 95% CI: 0.836-1.428, p=0.5059)。
図2

図3

表

本試験では主要評価項目のOSにおいて有意な改善を示すことができなかった。一方、RAM群ではPFS、TTP、奏効率を含む副次評価項目で臨床的に意義のある改善が認められ、忍容性が高く良好な安全性プロファイルを示した。また、ベースライン時におけるAFP高値は、RAMによるベネフィットを享受できる患者選択の指標となる可能性がある。肝細胞癌に対する2nd-lineは治療法が確立していないため、RAMについてさらなる検討が必要であると考えられる。
1) Llovet JM, et al.: J Clin Oncol. 31(28): 3509-3516, 2013 [PubMed]
2) Lencioni R, et al.: Int J Clin Pract. 68(5): 609-617, 2014 [PubMed]
3) Iavarone M, et al.: Hepatology. 54(6): 2055-2063, 2011 [PubMed]
4) Zhu AX, et al.: JAMA. 312(1): 57-67, 2014 [PubMed]
5) Zhu AX, et al.: Clin Cancer Res. 19(23): 6614-6623, 2013 [PubMed]
2) Lencioni R, et al.: Int J Clin Pract. 68(5): 609-617, 2014 [PubMed]
3) Iavarone M, et al.: Hepatology. 54(6): 2055-2063, 2011 [PubMed]
4) Zhu AX, et al.: JAMA. 312(1): 57-67, 2014 [PubMed]
5) Zhu AX, et al.: Clin Cancer Res. 19(23): 6614-6623, 2013 [PubMed]
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。

