The 37th ESMO Congress, 2012
2012年9月28日〜10月2日にオーストリア・ウィーンにて開催されたThe 37th ESMO Congress, 2012より、大腸癌や胃癌などの注目演題のレポートをお届けします。演題レポートの冒頭には、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。

日本人治癒切除不能大腸癌患者におけるPanitumumabの製造販売後調査:中間報告(3,005例)
Post-marketing survey of panitumumab in Japanese patients with unresectable colorectal cancer: Interim report of 3,005 patients
K. Sugihara, et al.
(写真は共同研究者のN. Boku氏)
(写真は共同研究者のN. Boku氏)

3rd-line以降でのOSの長さに注目

PanitumumabはEGFRを特異的に標的とする完全ヒト型IgG2モノクローナル抗体であり、KRAS 野生型の切除不能進行・再発大腸癌患者における1st-lineから3rd-line治療以降まで、単剤または細胞毒性抗癌剤との併用療法で使用されている。
日本においては2010年4月に承認されたが、臨床試験への日本人症例の登録が限られていたため、製造販売後調査として日本人患者における全例調査が行われた。
日本においては2010年4月に承認されたが、臨床試験への日本人症例の登録が限られていたため、製造販売後調査として日本人患者における全例調査が行われた。
製造販売後調査として2010年6月よりPanitumumab投与全例調査が開始され、2011年10月末までに収集された患者のデータに対する中間解析が行われた。
患者背景
今回の調査では2010年6月から2010年11月までに3,091例が登録され、そのうちPanitumumabを投与した3,005例について中間報告を行う。ベースライン時の患者背景は表の通りであり、KRAS 変異型への投与は3例、PS 4への投与は4例であった。
今回の調査では2010年6月から2010年11月までに3,091例が登録され、そのうちPanitumumabを投与した3,005例について中間報告を行う。ベースライン時の患者背景は表の通りであり、KRAS 変異型への投与は3例、PS 4への投与は4例であった。
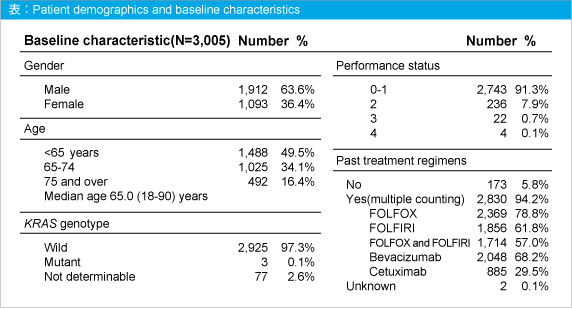
Panitumumabを含む治療レジメンは併用療法が半数以上を占め、治療ラインの割合は1st-line治療 10.4%、2nd-line治療 18.0%、3rd-line治療以降 71.6%であった。治療ライン別の選択された頻度の高かったレジメン内容は、1st-line治療ではFOLFOXが約6割、2nd-line治療ではFOLFIRIが約5割、3rd-line治療以降ではPanitumumab単独が約5割であった。
安全性
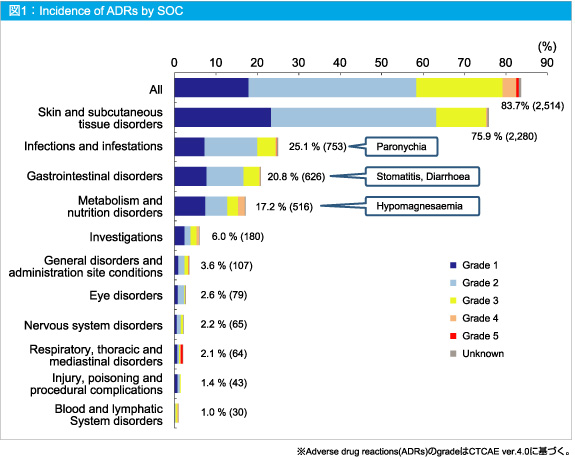
全体の副作用発現率は83.7%であった。副作用発現率 (1%以上) (器官別大分類による分類) は図1の通りであった。
安全性
全体の副作用発現率は83.7%であった。副作用発現率 (1%以上) (器官別大分類による分類) は図1の通りであった。
Panitumumabの重点調査項目は、皮膚障害、間質性肺疾患(ILD)、Infusion reaction、電解質異常、心毒性であり、これら副作用の発現率は図2の通りであった。
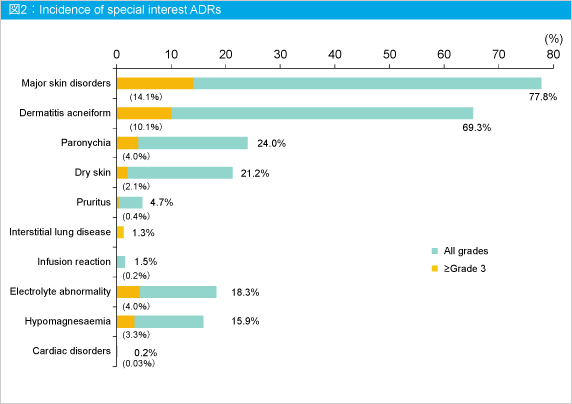
なお、皮膚障害による治療中止は6.3%であった (147/2,339例)。Grade 3以上の低マグネシウム血症、低カルシウム血症およびQT延長が認められた3例はCetuximabからの切り替え例2例も含み、抗EGFR抗体薬で長期間治療していた。Infusion reactionを以前発現した46例のうち29例 (63%) は初回投与の時点で発現した。ILDは1.3% (39*/3,005例) に発現し、0.6% (19*/3,005例) が死亡した。類薬における日本の製造販売後調査の発現率と大きな差はなかった。今回の死亡1,003例のほとんどは大腸癌に関連していたが、Panitumumabとの関連が否定できない死亡は26例であった。そのうち19*例がILDによる死亡であった。
*ILD分科会の評価に基づく
臨床効果
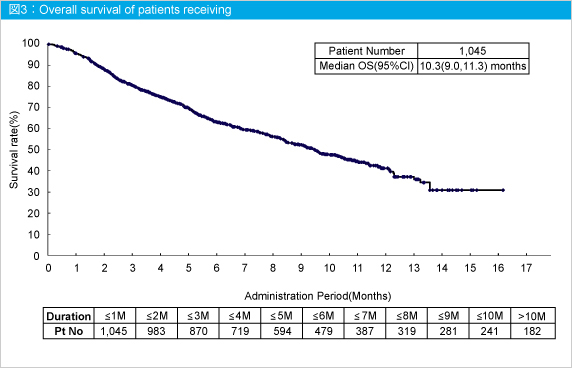
3rd-line治療以降にPanitumumabを単独で投与した場合の生存期間中央値は10.3カ月 (95%CI: 9.0-11.3) であった (図3)。
*ILD分科会の評価に基づく
臨床効果
3rd-line治療以降にPanitumumabを単独で投与した場合の生存期間中央値は10.3カ月 (95%CI: 9.0-11.3) であった (図3)。
日本において、Panitumumabは治癒切除不能大腸癌患者に対して適正に使用されていた。また、本集計において、製造販売後調査におけるPanitumumabの安全性、有効性は臨床試験での報告と同様であり、新たな安全性における懸念は認められなかった。なお、治癒切除不能大腸癌患者に対するPanitumumabのリスクとベネフィットのバランスは良好であった。
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。
