


AREGは、EREGとともにEGFRのリガンドであり、以前より、AREG、EREG高発現例において抗EGFR抗体薬の効果が高いことが報告されていた。本年の米国臨床腫瘍学会年次集会でも、同グループよりAREG/EREG発現レベルとEGFR遺伝子増幅を解析した結果、それぞれが独立した効果予測因子となり得ることが報告された。
今回の報告では、さらなる解析により、AREG発現およびEGFR遺伝子増幅が奏効率と有意な相関を示すことがわかった。そこで、それらを予後因子としたロジスティック回帰分析により、効果予測モデルが開発され、このアルゴリズムの効果予測曲線から予測奏効率が算出できるようになった。続いて、この予測モデルが正当であるかどうかを検証するために、本研究の検討の結果、cut-off値を50%と設定し (この類の解析では、そのcut-off値の設定が難しいが)、奏効および生存期間との相関を解析したところ、cut-off値以上で有意に奏効率が高く、cut-off値以下とでは実際の奏効率で有意な差が認められた (p=0.009)。また奏効率のみならずPFSやOSについても、cut-off値以上で、有意に長い生存期間であることが示された。
前述の如くAREG/EREG発現と効果の関係は、以前から言われていたものの、実際の評価方法などが決まっておらず、どのように臨床応用すべきかが注目されていたなか、本報告のような効果予測モデルが開発されたことは、抗EGFR抗体薬を用いた治療を実施する上で大きな意味を持つものと思われる。今後は、このモデルが、前向きの臨床試験において使用され、その効果予測が確かなものであることが立証されることが望まれる。
1st-lineとしてXELOX/XELIRI + Cetuximab療法を施行した切除不能進行・再発大腸癌患者について、EGFRのリガンドであるAREG/EREG発現レベルとEGFR遺伝子増幅を解析した結果、それぞれが独立した効果予測因子となり得ることが示唆されている1)。今回、さらに複合的な因子を用いて、治療効果との相関性を検討した。
AIO CRC-0104試験は、切除不能進行・再発大腸癌患者185例を対象として、XELOX + Cetuximab療法およびXELIRI + Cetuximab療法についての無作為化比較第II相試験であり、主要評価項目は奏効率であった。本解析では、年齢、性別、BRAF 変異、AREG/EREG発現レベル、EGFR遺伝子増幅レベル (FISH法) による多変量ロジスティック回帰分析から、奏効についての効果予測スコアを開発した。
AREG/EREG発現レベルおよびEGFR遺伝子増幅レベルについてのROC (receiver operating characteristic) 解析の結果、AREG発現およびEGFR遺伝子増幅が奏効率と有意な相関を示した。
AREG発現およびEGFR遺伝子増幅を予後因子としたロジスティック回帰分析により、効果予測モデルを開発した (図1アルゴリズム)。このアルゴリズムの効果予測曲線から、予測奏効率は以下より算出される。
exp(y) / [1 + exp(y)]
この効果予測モデルのROC解析により、AUC (area under the ROC curve) は0.79 (95%CI: 0.63-0.90)を示した (図1グラフ)。
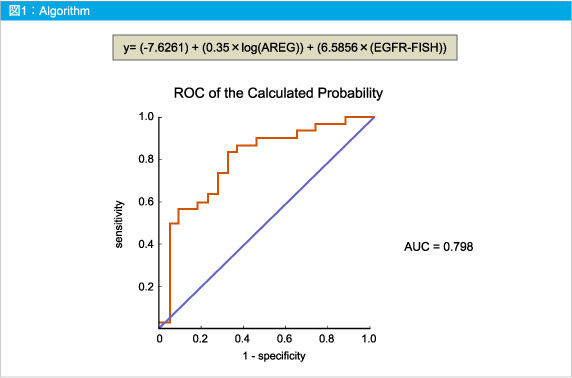
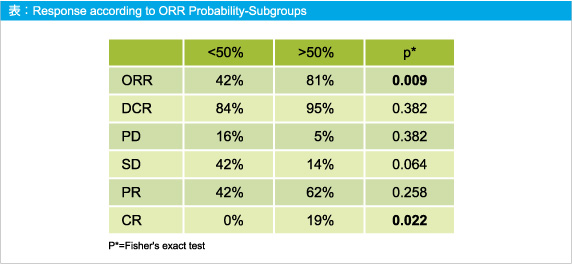
さらに、responderとnon-responderとを判定するために、予測奏効率のcut-off値50%を用いて奏効および生存期間との相関を検証し、本モデルの妥当性を評価した。
奏効率はcut-off値以上 (>50%) では81%、cut-off値以下 (<50%) では42%であり (p=0.009)、CRはそれぞれ19%と0%と統計学的有意差が認められた (p=0.022) (表)。
なお、PFS (progression-free survival) やOS (overall survival) についても、cut-off値以上 (>50%) で、有意に長い生存期間を示した。
今回の後ろ向き探索的研究では、分子マーカーによって奏効率の推定値を算出できることが示された。AREG発現およびEGFR遺伝子増幅による奏効率予測においてAUC測定は有効であり、これら2つの分子マーカーはCetuximab併用化学療法における奏効率予測のための有望な候補である。本報告の検証のためにも、前向き試験による分子マーカーの評価が必要である。
1) Sebastian S, et al.: 2012 Annual Meeting of the American Society of Clinical Oncology®: abst #3519 [学会レポート]
