瀧内:ここ数年、切除不能大腸癌に対する化学療法の著効によって治癒切除が可能となるconversion therapyが注目され、特に肝転移を有する症例では重要な治療の選択肢となっています。そこで今回は「Conversion therapy における第一選択薬」をテーマに、抗VEGF抗体派と抗EGFR抗体派に分かれて、プロコンを展開してまいります。
先日、本邦でもCetuximabの一次治療が承認されました(2010年3月)。現時点では抗EGFR抗体によるconversion therapyの経験はありませんが、来たる将来を見据えて活発な議論をお願いしたいと思います。なお、対象は「肝転移を有するKRAS野生型の大腸癌患者」とします。それでは、まず各派からプレゼンテーションをお願いします。
※本座談会は2010年3月26日収録です。

江見:Conversionによって生存期間の延長が認められ始めたのは、欧米でも2000年代の中ごろだったように思いますが、注目を浴びるようになったのは抗EGFR抗体が登場し、CRYSTAL試験の結果が発表されてからだと思います。
Conversion therapyに焦点を当てた比較試験はまだありませんが、CRYSTAL試験ではFOLFIRIにCetuximabを併用することで、肝転移のR0切除率が4.5%から9.8%に1)、OPUS試験でもKRAS野生型患者にFOLFOXとCetuximabを併用することでR0切除率が4.1%から 9.8%へと2)、いずれも2倍以上に増加しています。
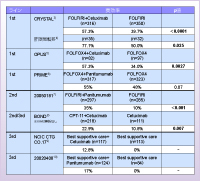
また、抗EGFR抗体全体でみても、Cetuximab、Panitumumabともにconversion therapyで要となる奏効率の上乗せが認められています(表1)。したがって、奏効率を高めるという点では、抗EGFR抗体は抗VEGF抗体に優っていると考えられます。
山﨑:最初からconversion therapyを定義することはなかなか難しく、palliative chemotherapyを行って手術ができた症例をレトロスペクティブに見て、「conversion therapyだった」という判断になることも多いと思いますが、CELIM試験11)を行ったFolprechtらにより、奏効率が上がるほど切除率が高くなる12)ことも報告されています。
Bevacizumabは単剤では殆ど腫瘍縮小効果はみられませんが、CetuximabやPanitumumabは単剤でもある程度の腫瘍縮小効果があるため9-10)、FOLFOXやFOLFIRI療法に上乗せすることで奏効率が高まります。実際、CRYSTAL試験やOPUS試験では、Cetuximabの追加によって奏効率が17~20数%上乗せされており3, 5)、なおかつ切除率が約2倍に上がっています。特に、肝臓に限局した場合の奏効率はCRYSTAL試験では77%(KRAS野生型)というデータもあり4)、抗EGFR抗体はconversion therapyに適していると思います。

仁科:FOLFOXまたはXELOXに対するBevacizumabの上乗せ効果を検討したNO16966 試験13)では、奏効率におけるBevacizumabの上乗せ効果は示されませんでしたが、IFL±Bevacizumabでは奏効率の上乗せが認められています(表2)14)。Cetuximab、Panitumumabほどではないにせよ、それでも併用したほうが奏効率が上がることは間違いありません。
CRYSTAL試験はFOLFIRIとの併用でしたが、肝転移のみの場合はFOLFIRIよりもFOLFOXのほうが転移巣の縮小率が高いことがV308 試験で示されていますし17)、安全性などの問題からも、一般にOxaliplatin(L-OHP)ベースのほうがよいと言われています。実際、NO16966 試験やFirst BEAT(大規模観察研究)においてBevacizumab併用化学療法を施行した肝限局転移症例では、R0切除率がいずれも約12%と報告されており18)、OPUS試験におけるR0切除率(9.8%)とほぼ同等です。したがって、Bevacizumab併用とCetuximab併用のR0切除率にはさほど差がないと思われます。また、技術的に切除不能な肝限局転移症例を対象にXELOX+Bevacizumab療法を検討したイギリスのBOXER試験19)では、33%(10例/30例)が切除可能になったと報告されています。重要なのは化学療法に抗体製剤を併用することであって、KRAS野生型においても、Bevacizumabが劣っているとは思いません。
髙橋:私もさまざまなエビデンスから、BevacizumabとCetuximabのR0切除率に大きな違いはないと考えています。我々外科医はできる限りconversion therapyを狙いますが、結果的に手術に至らない症例もあります。Bevacizumabを先に、Cetuximabを後に投与したほうが生存は良好というデータは私が知る限りありませんが、CetuximabにはBOND試験8)やNCIC CTG CO.17試験9)のように、2nd-lineや3rd-lineでも奏効するというデータがあります。したがってBevacizumabを早めに使い、次にCetuximabを使うほうが、全体としてはより良好なOSが得られるのではないかと考えられます。
また、L-OHPベースのレジメンではいわゆるblue liver(類洞拡張)が懸念されますが、Bevacizumabの併用によりblue liverが抑制される20)という報告があり、安心して切除できます。さらに、Bevacizumabを加えると病理学的にも有効であったという報告20-21)や、Bevacizumabを併用して肝切除ができた症例の2年生存率は良好である18)という報告もあります。このように、エビデンスが豊富であることもBevacizumabの利点です。
| ・ |
CRYSTAL試験(FOLFIRIとの併用)およびOPUS試験(FOLFOXとの併用)より、Cetuximab併用による肝転移R0切除率の増加が認められている。 |
| ・ |
Cetuximab、Panitumumabともに、単剤および化学療法併用における奏効率の有意な上乗せが示されている。 |
| ・ |
奏効率と切除率が相関すると考えると、奏効率の有意な上乗せ効果をもつ抗EGFR抗体のほうが、KRAS野生型患者に対するconversion therapyに適している。 |
| ・ |
NO16966試験ではBevacizumab併用による奏効率の上乗せは認められなかったが、IFL療法および5-FU/LVとの併用においては、有意な上乗せ効果が認められている。 |
| ・ |
NO16966試験およびFirst BEATでは、肝限局転移症例におけるR0切除率は約12%であり、OPUS試験の結果と比べても遜色ない。 |
| ・ |
Conversionを狙っても実際は切除に至らない症例のほうが多く、1st-lineとして長く投与するのであれば、Bevacizumabを選びたい。 |
| ・ |
BevacizumabにはL-OHPによるblue liverを抑制する効果が認められており、L-OHPレジメンとの併用が主体となるconversion therapyに適している。 |