Abstract #573
抗EGFR抗体薬治療を行った切除不能進行・再発大腸癌の予後に対して拡大BRAF 変異が与える臨床的影響:BREAC試験
Clinical Impact of Expanded BRAF Mutational Status on the Outcome for Metastatic Colorectal Cancer Patients with Anti-EGFR Antibody: An Analysis of the BREAC Trial (Biomarker Research for Anti-EGFR Monoclonal Antibodies by Comprehensive Cancer Genomics)
Kentaro Yamazaki, et al.
“Beyond BRAF V600E“の可能性
抗EGFR抗体薬の治療応答性予測は、
KRAS exon 2野生型からAll
RAS 野生型へ移行している (Beyond
KRAS)。同時に、
BRAF V600Eは大腸癌における予後因子であり、
BRAF 遺伝子変異陽性例を対象とした
BRAF 阻害剤 + MEK阻害剤 + 抗EGFR抗体薬の臨床試験が進行している
1)。
本発表は、①日本人大腸癌患者150例において、
BRAF V600E変異は9例 (6.0%)、V600E以外の変異は7例 (4.7%) に認められたこと、②
BRAF V600E以外の変異を有する患者も、
BRAF V600Eと同様に抗EGFR抗体薬投与時の予後が不良であったこと、を初めて示した。発表者の山崎先生、吉野先生に伺ったところ、
BRAF V600E以外の変異の頻度は白人では約1%であるがアジア人では約5%とethnic differenceが存在し、まずは
BRAF V600E以外の変異の機能解析を行うとのことであった。今後の“Beyond
BRAF V600E“の可能性に期待したい。
背景と目的
切除不能進行・再発大腸癌患者においてBRAF V600E変異は予後因子として知られている2, 3)。これまで既治療の切除不能進行・再発大腸癌患者に対する抗EGFR抗体薬の抵抗性とBRAF V600E変異との間に有意な関連があることが報告されているものの4-7)、BRAF V600E変異以外のBRAF 変異が及ぼす臨床的な影響についての報告はほとんどない。
本研究では、切除不能進行・再発大腸癌患者に対する抗EGFR抗体薬の新規バイオマーカー探索を目的に行われた後ろ向きの多施設共同試験 (BREAC試験) に登録されたホルマリン固定パラフィン包埋検体 (FFPE) を用い、RAS /BRAF 変異と抗EGFR抗体薬の効果との関連を評価した。
対象と方法
BREAC試験では2008年9月〜2010年5月に探索的コホートが行われ、抗EGFR抗体薬に対する著効例 (super-responder: CR, PR, long SD) と、無効例 (non-responder: 初回評価時PD) から検体を収集して全エクソン変異解析を行い、抗EGFR抗体薬のバイオマーカー候補遺伝子が探索された。続いて、2010年6月〜2012年6月には推測コホートとして他の連続サンプルを集積し、探索コホートにおいてバイオマーカー候補とされたKRAS 、NRAS 、BRAF とその他28遺伝子と、抗EGFR抗体薬の有効性との関連を評価した。
本研究は、推測コホートにおけるRAS (KRAS 、NRAS ) /BRAF 解析である。
結果
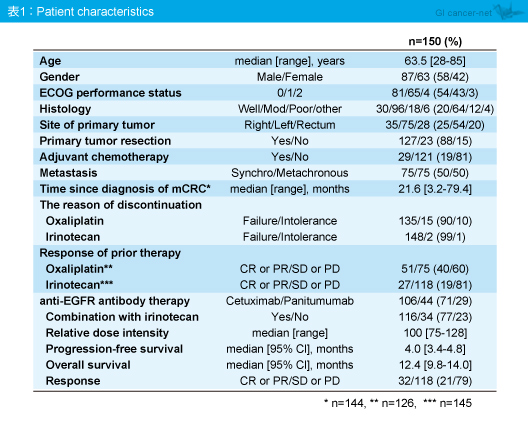
BREAC試験の推測コホートに登録された184例中150例からRAS /BRAF 解析結果が得られた。患者背景は、年齢中央値63.5歳、男性/女性は58%/42%、ECOG PS 0/1が大半を占め、抗EGFR抗体薬はCetuximabが71%、Panitumumabが29%に用いられていた。なお、対象症例におけるPFS中央値は4.0ヵ月、OS中央値は12.4ヵ月、奏効率は21%であった (表1)。
RAS 変異は40例、BRAF 変異は16例で検出され、両変異は相互排他的であった。また、BRAF V600E以外のBRAF 変異はすべてキナーゼドメインに位置していた (表2)。
RAS およびBRAF がすべて野生型 (RAS /BRAF 野生型)、RAS およびBRAF のいずれかが変異型 (RAS /BRAF 変異型)、RAS がすべて野生型 (RAS 野生型)、RAS およびBRAF V600Eがすべて野生型 (RAS /BRAF V600E野生型)、いずれかのRAS が変異型 (RAS 変異型)、BRAF V600Eだけが変異型 (BRAF V600E変異型)、BRAF V600E以外のいずれかのBRAF 変異型 (RAS other変異型) の7タイプに分けて有効性の解析を行った。
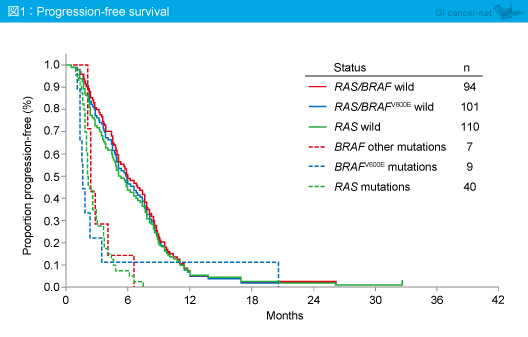
PFS中央値はRAS /BRAF 野生型5.9ヵ月、RAS /BRAF 変異型2.1ヵ月と、RAS /BRAF 変異型に比べてRAS /BRAF 野生型で有意に良好であった (HR=3.49, p<0.0001) (図1)。なお、RAS 変異型のPFS中央値は2.1ヵ月、BRAF V600E変異型は1.6ヵ月、BRAF other変異型は2.4ヵ月であり、いずれもPFSが不良であった。
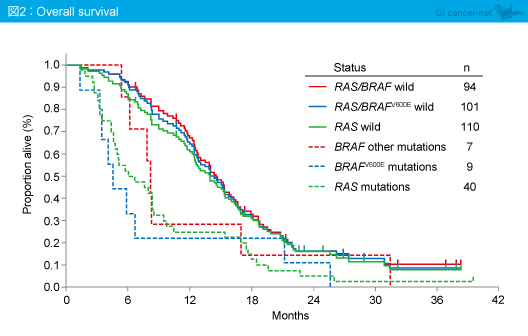
OS中央値はRAS /BRAF 野生型14.5ヵ月、RAS /BRAF 変異型6.4ヵ月と、RAS /BRAF 変異型に比べてRAS /BRAF 野生型で有意に良好であった (HR=2.14, p<0.0001) (図2)。なお、RAS 変異型のOS中央値は6.3ヵ月、BRAF V600E変異型は4.6ヵ月、BRAF other変異型は8.1ヵ月であり、いずれも予後不良であった。
奏効率も、RAS /BRAF 野生型31.9%に対して、RAS /BRAF 変異型は1.8% (RAS 変異型2.5%、BRAF V600E変異型0%、BRAF other変異型0%) と不良であった。
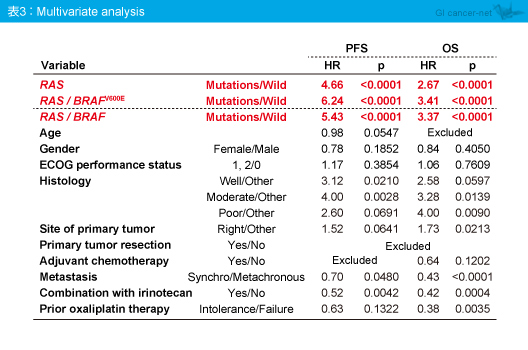
多変量解析の結果、RAS 変異、RAS /BRAF V600E変異に加え、RAS /BRAF 変異も抗EGFR抗体薬の有意な効果予測因子として同定された (表3)。
結論
切除不能進行・再発大腸癌に対する抗EGFR抗体薬の有効性において、BRAF V600E以外のBRAF 変異もRAS 変異やBRAF V600E変異と同様の結果を示し、抗EGFR抗体薬による治療が奏効しない患者の検出に拡大BRAF 変異が役立つ可能性が示唆された。今後、これら拡大BRAF 変異の臨床的影響についてさらなる検討が必要である。
Reference
1) ClinicalTrials.gov:
BRAF/MEK/EGFR Inhibitor Combination Study in Colorectal Cancer
2) Lochhead P, et al.: J Natl Cancer Inst. 105(15): 1151-1156, 2013[
PubMed]
3) Venderbosch S, et al.: Clin Cancer Res. 20(20): 5322-5330, 2014[
PubMed]
4) Di Nicolantonio F, et al.: J Clin Oncol. 26(35): 5705-5712, 2008[
PubMed]
5) Laurent-Puig P, et al.: J Clin Oncol. 27(35): 5924-5930, 2009[
PubMed]
6) De Roock W, et al.: Lancet Oncol. 11(8): 753-762, 2010[
PubMed]
7) Bando H, et al.: BMC Cancer. 13: 405, 2013[
PubMed]