Abstract #513
切除不能進行・再発大腸癌に対するFamitinibの多施設共同無作為化二重盲検並行群間第II相試験
A Randomized Double-blind, Parallel-group, Placebo Controlled, Multi-center, Phase II Clinical Study of Famitinib in the Treatment of Advanced Metastatic Colorectal Cancer
Rui-hua Xu, et al.
主要評価項目は達成するも、臨床導入には高い壁
Famitinibはc-Kit、VEGFR2、PDGFR、VEGFR3 などを標的としたチロシンキナーゼ阻害剤であり、Sunitinibと類似した構造、プロファイルを持っている。本試験ではサルベージラインにおける検討が行われ、PFSはプラセボ群の1.5ヵ月に対してFamitinib群2.8ヵ月と、薬剤として効果があることが示唆されたが (HR=0.596, p=0.0053)、OSのKaplan-Meier曲線はほぼ重なっていた。したがって、演者は今後の試験を行うことが保証されたと結論しているものの、2014年に上市されたTAS-102 (ロンサーフ
®) が無作為化第II相試験の段階でOS曲線に開きがみられていたことを考えると、このままの形での第III相試験は現実的でないと考える。Discussantは他の抗癌剤との併用や、他の分子標的薬との併用を示唆してはいたが、経口チロシンキナーゼ阻害剤 (
Cediranib、
Sunitinib) が標準治療であるFOLFOXやFOLFIRIとの併用で優越性を示せていないことを考えると、併用による有望なシグナルが今後の試験で示唆されない限り、近日中にベッドサイドに届くのは難しいであろう。
背景と目的
中国では切除不能進行・再発大腸癌に対する1st-line、2nd-lineとしてmFOLFOXやFOLFIRIが用いられているが、分子標的薬はCetuximabとBevacizumabが使用できるのみで、2nd-line後における標準治療は存在しない。
Famitinibは低分子のマルチターゲットチロシンキナーゼ阻害剤であり、VEGFR2、c-Kit、PDGFRを主な標的とし、血管新生に対して働く。本試験は、切除不能進行・再発大腸癌に対するFamitinibの有効性と安全性を評価することを目的とした第II相試験である。
対象と方法
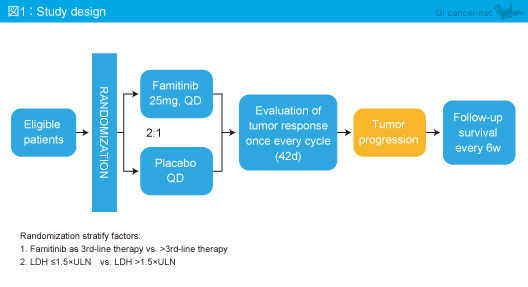
対象は、18〜70歳、ECOG PS 0/1、1つ以上の評価可能病変を有し、5-FU、CPT-11、L-OHPを含む標準的化学療法を2ライン以上施行された切除不能進行・再発大腸癌患者であり、Famitinib (25mg/日) を投与する群 (Famitinib群) とプラセボを投与する群 (プラセボ群) に2:1の割合で無作為に割り付けられた (図1)。主要評価項目はPFS、副次評価項目はOS、奏効率、病勢コントロール率、QOLであり、最終のPFS、OS解析はイベント発生率80%の時点で行うものとした。
結果
2012年7月〜2013年3月に中国の19の施設から154例が登録され、Famitinib群99例、プラセボ群55例に割り付けられた。なお、両群の患者背景は同等であった。
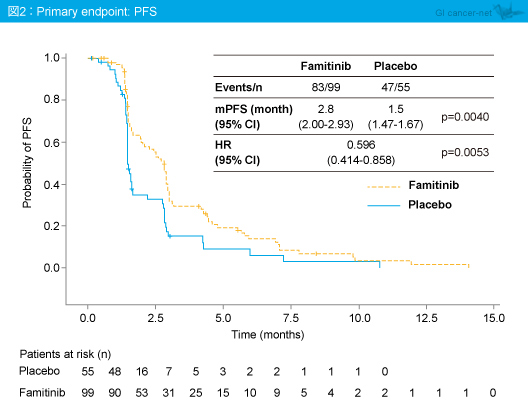
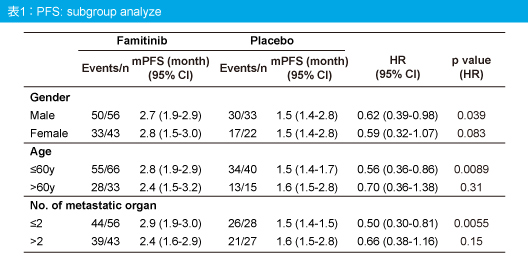
主要評価項目のPFS中央値はFamitinib群2.8ヵ月、プラセボ群1.5ヵ月で、Famitinib群で有意な延長が認められた (HR=0.596, 95% CI: 0.414-0.858, p=0.0053) (図2)。PFSのサブグループ解析では、男性 (p=0.039)、60歳以下 (p=0.0089)、転移臓器数2以下 (p=0.0055) において、Famitinib群で有意に良好であった (表1)。
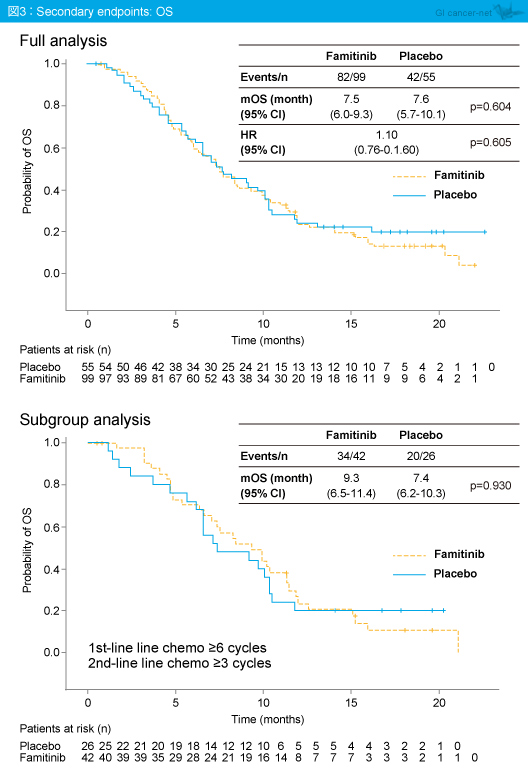
OS中央値はFamitinib群7.5ヵ月、プラセボ群7.6ヵ月と両群間に有意差は認められなかった (HR=1.10, 95% CI: 0.76-1.60, p=0.605) (図3)。なお、1st-lineを6サイクル以上、2nd-lineを3サイクル以上施行した症例におけるサブグループ解析では、有意差は認めなかったもののFamitinib群で良好な傾向がみられた。
奏効率はFamitinib群2.2% (PR 2例)、プラセボ群0%と有意差を認めなかったが (p=0.54)、病勢コントロール率はそれぞれ59.8%、31.4%と、Famitinib群で有意に良好であった (p=0.0016)。なお、試験薬に関連したQOLの有意な低下は認められなかった。
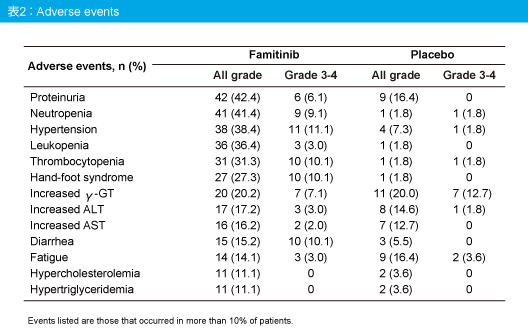
Grade 3以上の薬剤関連有害事象はFamitinib群46.5%、プラセボ群20.0%に認められ、有害事象による治療中止はそれぞれ13.1%、5.5%であった。主な有害事象はタンパク尿、好中球減少、高血圧、白血球減少、血小板減少、手足症候群などであった (表2)。
結論
既治療の切除不能進行・再発大腸癌に対して、Famitinib単剤療法は主要評価項目であるPFSを有意に延長した。安全性は他の低分子VEGFR阻害剤とほぼ同様であり、忍容性も良好で管理可能であった。なお、OSについては前治療を完遂した患者で良好な傾向がみられたことから、本集団についてはさらなる検討が必要である。