Abstract #512
切除不能進行・再発大腸癌に対するフッ化ピリミジン系製剤 + L-OHP + Bevacizumab治療後の2nd-lineとしてのFOLFIRI ± Ramucirumabの多施設共同無作為化二重盲検第III相試験(RAISE試験)
RAISE: A Randomized, Double-blind, Multicenter Phase III Study of Irinotecan, Folinic Acid, and 5-Fluorouracil (FOLFIRI) Plus Ramucirumab or Placebo in Patients with Metastatic Colorectal Carcinoma Progression During or Following First-line Combination Therapy with Bevacizumab, Oxaliplatin, and a Fluoropyrimidine
Josep Tabernero, et al.
大腸癌治療の新たな分子標的薬Ramucirumab登場、Bevacizumabとの差別化は可能か?
2015年消化器癌シンポジウムの発表演題中、一番の目玉の試験であり、最も注目を集めた発表であろう。
RAISE試験のOSにおけるsurvival benefitと高い忍容性に異を唱える者はいないと考える。結果として、FOLFIRI + Ramucirumab療法は、Bevacizumab、L-OHP、フッ化ピリミジン系製剤を用いた1st-line後の2nd-lineにおける新たな標準治療として位置づけられることになった。では、「BBP (Bevacizumab beyond progression) のBevacizumabとどこが違い、どう使い分けるのか?そしてRamucirumabの意義は?」、真っ先に浮かぶ臨床的疑問である。
BBPを証明した
TML試験1)と本試験をそれぞれ比較すると、
TML試験 vs. RAISE試験ではPFSのHRが0.68 vs. 0.79、OSのHRが 0.81 vs. 0.84と相違なく(TML試験のHRはunstratified)、奏効率も
TML試験ではBevacizumab群5%、対照群4%、RAISE試験ではRamucirumab群13.4%、対照群12.5%といずれも化学療法単独に対する上乗せ効果を認めない結果であった。毒性に関しては、
TML試験ではBevacizumabによる毒性増強は認められなかったが、RAISE試験ではRamucirumab群で好中球減少、倦怠感、高血圧が若干高頻度であった。注意は必要であるが、忍容性の点でさして問題にはならない。
プラセボ対照であり対象症例の絞り込みの点から、質の高さとエビデンスの硬さという点ではRAISE試験に軍配が上がると考えるが、現時点の臨床現場で両薬剤を使い分けるほどの相違はないと言わざるを得ない。つまり、現状、上記疑問に明確に答えることはできないのである。有り体に言えば、本試験の追加解析、特にバイオマーカー解析の結果を期待したいところであるが、今までの血管新生阻害剤の状況を鑑みれば、それがかなり困難であると容易に想像される。一方、Ramucirumabは単剤でも有効性が期待できる点など、Bevacizumabとは作用メカニズムが異なっている。その違いを利用した実地臨床での使用や新たな臨床試験により、今後Bevacizumabとの差別化が図られていくことに期待したい。
背景と目的
VEGFおよびVEGFR-2はシグナル伝達や血管新生のメディエーターであり、大腸癌の腫瘍増殖に重要な役割を果たすため、治療標的となっている。Ramucirumabは組換え型ヒトIgG1モノクローナル抗体薬であり、VEGFR-2の細胞外ドメインに結合し、リガンド結合を阻害することで受容体活性を低下させる。
RAISE試験は、Bevacizumab、L-OHP、フッ化ピリミジン系製剤を用いた1st-line後に病勢進行を認めた切除不能進行・再発大腸癌患者に対する2nd-lineとして、FOLFIRI + Ramucirumabの有効性と安全性を評価する第III相試験である。
対象と方法
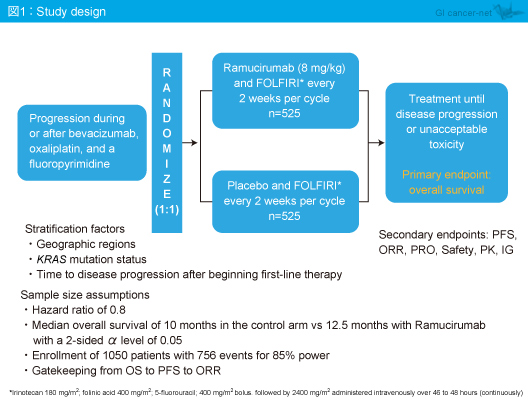
対象は、ECOG PS 0/1で臓器機能が保たれており、Bevacizumab(2回以上投与)、L-OHP、フッ化ピリミジン系製剤を用いた1st-lineの治療中もしくは最終投与から6ヵ月以内に病勢進行を認めた切除不能進行・再発大腸癌患者であり、FOLFIRI + Ramucirumab(8mg/kg)を2週毎に投与する群(Ramucirumab群)とFOLFIRI + プラセボを2週毎に投与する群(プラセボ群)に1:1で無作為に割り付けられた(図1)。
主要評価項目はOSであり、副次評価項目はPFS、奏効率、患者報告アウトカム、安全性などであった。なお、OSの中央値をプラセボ群10ヵ月、Ramucirumab群12.5ヵ月と仮定し(HR=0.8)、検出力85%、両側α=0.05で必要症例数は1,050例であった。
結果
1,072例が無作為化され、Ramucirumab群536例、プラセボ群536例に割り付けられた。なお、層別因子としてKRAS 変異、1st-line後の増悪までの期間、地域が用いられ、KRAS 変異型はRamucirumab群50.2%、プラセボ群48.7%、1st-line後の増悪までの期間が6ヵ月未満の症例はそれぞれ23.3%、24.1%であった。
両群の患者背景はほぼ同等であり、年齢中央値は両群とも62歳、アジア人がRamucirumab群20.7%、プラセボ群19.2%、転移巣の数が3以上の症例はそれぞれ29.3%、34.0%、肝限局転移例はそれぞれ17.2%、17.7%であった。
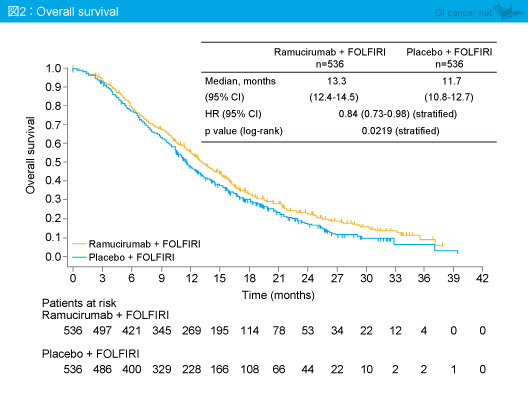
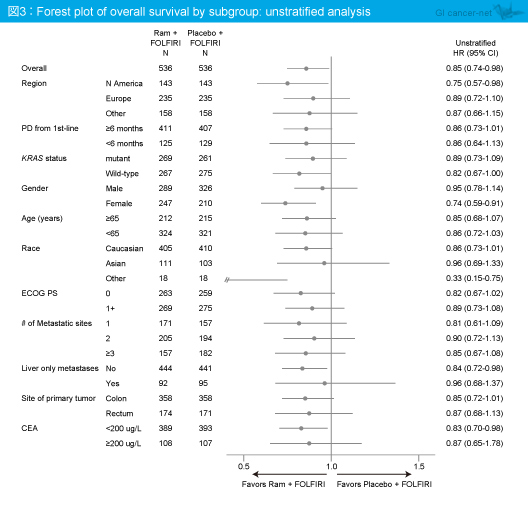
主要評価項目のOS中央値はRamucirumab群13.3ヵ月、プラセボ群11.7ヵ月であり、Ramucirumab群で有意な延長を認めた(HR=0.84, 95% CI: 0.73-0.98, p=0.0219)(図2)。また、OSのサブグループ解析では、いずれのサブグループにおいてもRamucirumab群で良好であった(図3)。
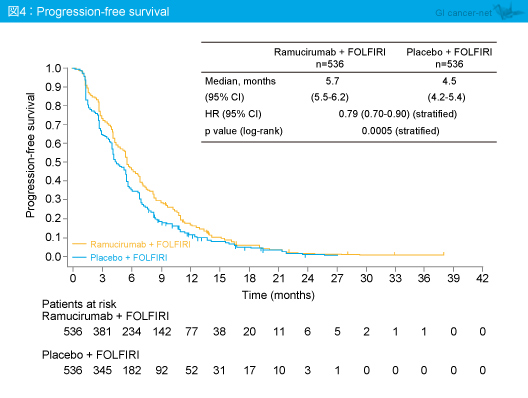
PFS中央値はRamucirumab群5.7ヵ月、プラセボ群4.5ヵ月であり、Ramucirumab群で有意な延長を認めた(HR=0.79, 95% CI: 0.70-0.90, p=0.0005)(図4)。
奏効率はRamucirumab群13.4%、プラセボ群12.5%(p=0.6336)、病勢コントロール率はそれぞれ74.1%、68.8%であり(p=0.0587)、有意差は認めなかったもののRamucirumab群で良好な傾向がみられた。
後治療として全身化学療法を受けた症例はRamucirumab群54.1%、プラセボ群56.0%で、使用薬剤は両群で概ね同等であった。また、治療サイクル中央値は8サイクルであり、相対用量強度(RDI)中央値は、Ramucirumabが85.89%、5-FUがRamucirumab群69.96%、プラセボ群82.26%、CPT-11がそれぞれ74.87%、84.42%であった。
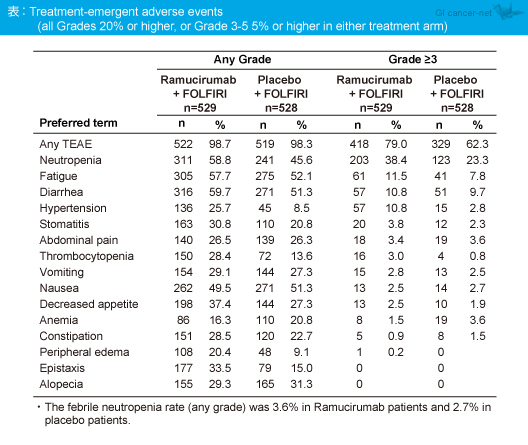
Grade 3以上の治療関連有害事象はRamucirumab群79.0%、プラセボ群62.3%に認められた(表)。なお、Ramucirumab群はプラセボ群に比べて好中球減少、倦怠感、高血圧、血小板減少が多く認められたが、発熱性好中球減少症(全grade)はRamucirumab群3.6%、プラセボ群2.7%といずれも低値であった。
結論
切除不能進行・再発大腸癌に対する2nd-lineとしてのFOLFIRIへのRamucirumab併用はOSを有意に改善し、いずれのサブグループにおいても良好であった。また、FOLFIRI + Ramucirumabの忍容性は良好で、有害事象は管理可能であった。
Reference
1) Bennouna J, et al.: Lancet Oncol. 14(1): 29-37, 2013 [
PubMed]