Abstract #511
術前肝局所動注化学療法 (PHRAC) による大腸癌治癒切除術後の異時性肝転移の発現抑制:多施設共同前向き無作為化比較試験
Preoperative Hepatic and Regional Arterial Chemotherapy (PHRAC) Reduces the Occurrence of Metachronous Liver Metastasis after Curative Colorectal Cancer Resection: A Prospective, Multi-center, Randomized Controlled Trial
Jianmin Xu, et al.
PHRACの有効性を認めたものの、まだ検討が必要
標準的な術後補助化学療法であるFOLFOXに、術前7日前に肝動注療法および所属血管への動注療法を行うことを検証した試験である。動注の薬剤はFloxuridine (FUDR) 650mg、 Oxaliplatin (L-OHP) 75mg、Mitomycin-C (MMC) 8mgである。なお、術後補助化学療法として使用したmFOLFOX6療法は8サイクルであり、標準治療より短期間であった。
結果は有意に5年DFSを改善しており (HR=0.60, 95% CI: 0.45-0.80, p<0.001)、肝転移率も有意に低下している (HR=0.39, 95% CI: 0.24-0.64, p<0.001)。よくデザインされた第III相試験であり、非常に重要な結果である。しかしながら、stage IIIにおける対照群の5年DFSが50%程度と、従来の試験よりやや悪い印象があり、術前評価の精度や動注の完遂率なども結果に影響することが考えられる。
背景と目的
大腸癌における初回切除後の5年肝転移率は、stage Iの3.7%に対し、stage IIは13.3%、stage IIIは30.4%と高率である1)。原発巣切除により微小転移が亢進する可能性が指摘されており、肝転移予防として微小転移に対する術前の治療が検討されている2, 3)。
正常肝細胞への血液供給が主に門脈を介するのに対し、肝転移への血液供給の多くは肝動脈を介することから、肝動注化学療法は正常細胞への薬剤曝露を最小限としつつ、転移巣へ高濃度の薬剤を送達する可能性がある4, 5)。また、Xu氏らが単施設で行った無作為化試験では、術前肝局所動注化学療法 (PHRAC) はstage III大腸癌患者において肝転移を抑制し、3年OSを改善することが示されている6)。そこで今回、前向きの多施設共同無作為化第III相試験によりPHRACの評価を行った。
対象と方法
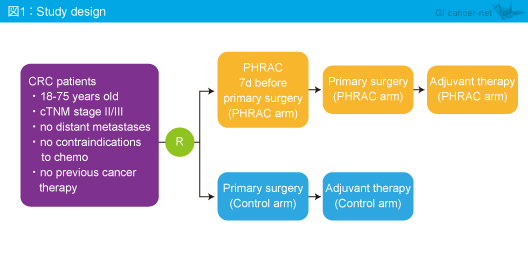
対象は、年齢18〜75歳、遠隔転移がなく、未治療のstage II/III大腸癌患者であり、初回切除後に術後補助化学療法を行う群 (対照群) と、初回切除 + 術後補助化学療法に加え手術の7日前にPHRACを施行する群 (PHRAC群) に無作為に割り付けられた (図1)。PHRACは、Floxuridine (FUDR) (650mg/m2) + Oxaliplatin (L-OHP) (75mg/m2) + Mitomycin-C (MMC) (8mg/m2) を上腸間膜動脈 (SMA) および総肝動脈 (CHA) から半量ずつ投与した。また、術後補助化学療法は、術後4週以内にmFOLFOX6を開始し、直腸癌に対しては必要に応じて放射線療法を施行した。主要評価項目はDFSで、副次評価項目は肝転移の累積発現率、OS、安全性であった。
結果
2008年12月〜2012年12月に中国の5施設にて688例が登録され (ITT集団)、PHRAC群341例、対照群347例に無作為に割り付けられた。また、適格例は627例 (それぞれ313例、314例) であった。ITT集団の患者背景は両群でバランスが取れており、65歳未満/65歳以上がPHRAC群287例/67例、対照群272例/83例、ECOG PS 0/1がそれぞれ294例/47例、303例/44例、結腸癌/直腸癌がそれぞれ172例/169例、187例/160例、stage II/IIIがそれぞれ182例/139例、170例/156例であった。
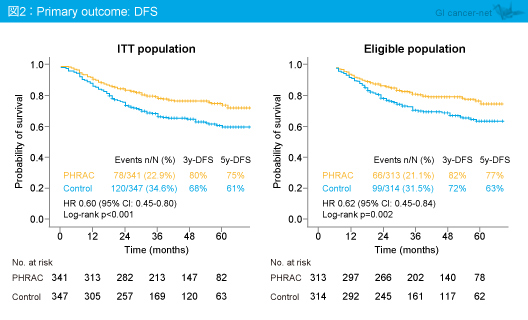
主要評価項目であるDFSは、ITT集団における5年DFSがPHRAC群75%、対照群61%であり、PHRAC群で有意に良好であった (HR=0.60, 95% CI: 0.45-0.80, p<0.001) (図2)。また、適格例においてもPHRAC群で有意に良好であった (HR=0.62, 95% CI: 0.45-0.84, p=0.002)。
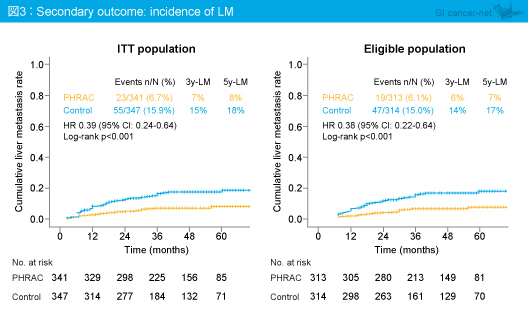
適格例における初回DFSイベントとしての肝転移発現率は、PHRAC群6.1%、対照群15.0%と、PHRAC群で有意に良好であった (p<0.001)。また、ITT集団および適格例における肝転移発現率はいずれもPHRAC群で有意に良好であった (ともにp<0.001) (図3)。なお、肝転移発現までの期間はPHRAC群で長い傾向がみられたが有意差はなかった。
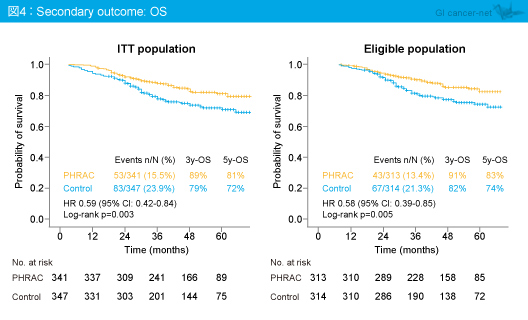
OSは、ITT集団における5年OSがPHRAC群81%、対照群72%と、PHRAC群で有意な延長を認め (HR=0.59, 95% CI: 0.42-0.84, p=0.003)、適格例においても有意差を認めた (HR=0.58, 95% CI: 0.39-0.85, p=0.005) (図4)。
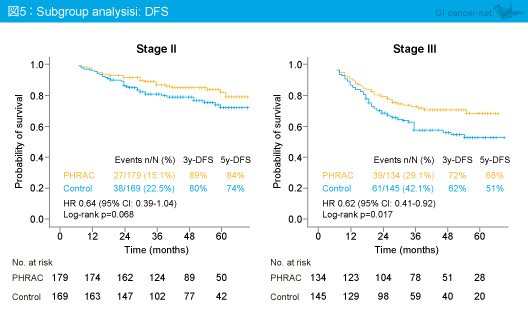
Stage別のサブグループ解析では、DFS (図5)、肝転移発現率、OSのいずれもstage IIIではPHRAC群で有意に良好であり、stage IIではPHRAC群で良好な傾向がみられたものの有意差は認められなかった。なお、肝転移発現までの期間はstage IIに比べてstage IIIのほうがPHRACによる改善効果がみられたが、いずれも有意差は認められなかった。
有害事象は、PHRAC施行によりgrade 3以上の悪心・嘔吐、ALT上昇、白血球減少/好中球減少がみられたものの、術後合併症の発症率は両群で同等であり (p=0.892)、PHRACによる影響はみられなかった。
結論
PHRACは手術や術後合併症に影響を及ぼさず、安全で実行可能である。また、肝転移再発率の低下、DFSおよびOSの改善を認め、特にstage III大腸癌において有用であると考えられる。
Reference
1) Manfredi S, et al.: Ann Surg. 244(2): 254-259, 2006[
PubMed]
2) Finlay IG, et al.: Br J Surg. 75(7): 641-644, 1988[
PubMed]
3) Demicheli R, et al.: Ann Oncol. 19(11): 1821-1828, 2008[
PubMed]
4) Kemeny N, et al.: N Engl J Med. 341(27): 2039-2048, 1999[
PubMed]
5) Kemeny MM, et al.: J Clin Oncol. 20(6): 1499-1505, 2002[
PubMed]
6) Xu J, et al.: Ann Surg. 245(4): 583-590, 2007[
PubMed]