Abstract #2
進行胃食道腺癌 (GEC) に対するFOLFOX±MET阻害剤Onartuzumabの無作為化第II相試験
Randomized Phase II Study of FOLFOX ± the MET Inhibitor, Onartuzumab, in Advanced Gastroesophageal Adenocarcinoma (GEC)
Manish A. Shah, et al.
HGF-MET経路に対する薬剤開発に光は射すか
Onartuzumabがなぜ成功しなかったか。1st-lineにおける効果が得られなかったこととして、①免疫染色だけでは、適切なenrichmentができていない可能性、②FOLFOXとの併用の相性 (毒性の増加、併用による拮抗作用など)、単剤治療に適するが併用が難しい薬剤である可能性、③効果が得られる対象が1st-lineよりも後のラインである可能性、などが考えられる。METのリガンドであるHGFに対する抗体であるRilotumumabの、胃癌1st-lineにおける2本の第III相試験が無効中止になったことが報告されており、HGF-METシグナルをブロックすることの難しさが示されている。Early phaseではdramaticな奏効がみられている症例もあるなかで、この薬剤、このtargetの開発を諦めるのではなく、対象や治療ラインなど、より適切な症例の絞り込み、IHCのみならず増幅も検討することなどが期待される。
背景と目的
METの過剰発現は胃癌の13〜22%に認められ1, 2)、MET高発現胃癌は予後不良であることが報告されている3)。Onartuzumabは一価完全ヒト型抗MET抗体薬であり、胃食道腺癌に対する第I、II相試験において活性が確認されている4, 5)。今回、転移を有するHER2陰性胃食道腺癌に対する1st-lineとしてのmFOLFOX6に対するOnartuzumabの上乗せ効果を検討する無作為化第II相試験が行われた。
対象と方法
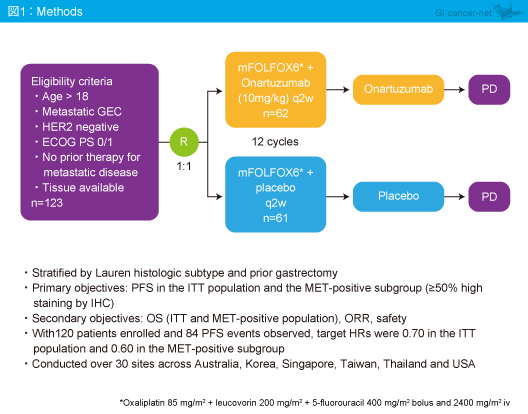
対象は、18歳以上、HER2陰性、ECOG PS 0/1で、転移を有し治療歴がない胃食道腺癌患者であり、mFOLFOX6 + Onartuzumabを12サイクル投与後PDまでOnartuzumab を継続投与する群 (mFOLFOX6 + Onartuzumab群) もしくはmFOLFOX6 + プラセボを12サイクル投与後PDまでプラセボを継続投与する群 (mFOLFOX6 + プラセボ群) に1:1で無作為に割り付けられた (図1)。
主要評価項目はITT集団およびMET陽性集団 (MET IHCスコア2以上;カットオフ50%) におけるPFS、副次評価項目はITT集団およびMET陽性集団におけるOS、奏効率、安全性であった。なお、120例の登録で84件のPFSイベントが発生すると仮定し、目標ハザード比はITT集団で0.70、MET陽性集団で0.60であった。
結果
123例が登録され、mFOLFOX6 + Onartuzumab群62例、mFOLFOX6 + プラセボ群61例に割り付けられた。ベースライン時の患者背景は両群同等であり、アジア人はmFOLFOX6 + Onartuzumab群56.5%、mFOLFOX6 + プラセボ群59.0%であり、原発巣が胃癌の症例はそれぞれ74.2%、78.7%、胃癌切除施行例はそれぞれ37.1%、32.8%であった。なお、MET陽性患者は50%カットオフでmFOLFOX6 + Onartuzumab群28%、mFOLFOX6 + プラセボ群33%、90%カットオフではそれぞれ10%、14%であった。
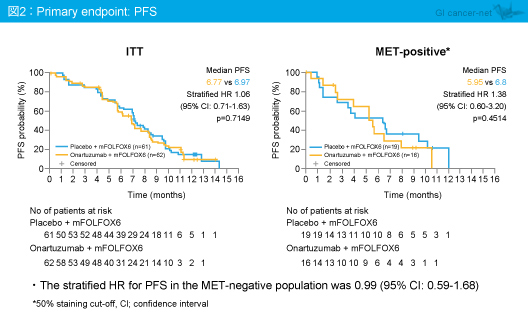
主要評価項目のPFS中央値は、ITT集団ではmFOLFOX6 + Onartuzumab群6.77ヵ月、mFOLFOX6 + プラセボ群6.97ヵ月であり (HR=1.06, 95% CI: 0.71-1.63, p=0.7149)、MET陽性集団ではそれぞれ5.95ヵ月、6.8ヵ月 (HR=1.38, 95% CI: 0.60-3.20, p=0.4514) であった (図2)。
PFSのサブグループ解析においてもOnartuzumabの有意な効果が認められるサブグループは同定されなかった。また、MET陽性の定義をカットオフ90%とした探索的な解析においてもPFSは同様の結果であった。
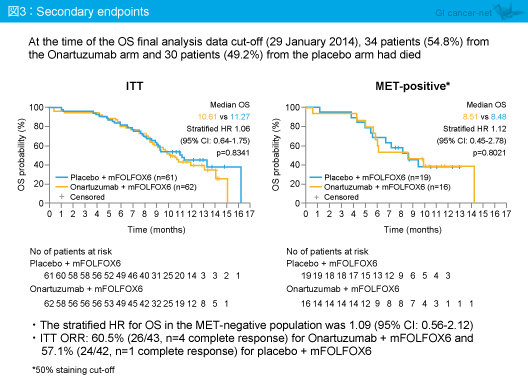
副次評価項目のOS中央値は、ITT集団ではmFOLFOX6 + Onartuzumab群10.61ヵ月、mFOLFOX6 + プラセボ群11.27ヵ月であり (HR=1.06, 95% CI: 0.64-1.75, p=0.8341)、MET陽性集団ではそれぞれ8.51ヵ月、8.48ヵ月 (HR=1.12, 95% CI: 0.45-2.78, p=0.8021) であった (図3)。
ITT集団における奏効率は、mFOLFOX6 + Onartuzumab群60.5% (26/43例: CR 4例)、mFOLFOX6 + プラセボ群57.1% (24/42例: CR 1例) であった。
なお、アジア人と非アジア人に分けた検討では、PFS中央値がアジア人ではmFOLFOX6 + Onartuzumab群6.9ヵ月、mFOLFOX6 + プラセボ群7.1ヵ月 (HR=1.28, 95% CI: 0.74-2.21)、非アジア人ではそれぞれ6.7ヵ月、6.8ヵ月 (HR=0.83, 95% CI: 0.45-1.53)、OS中央値がアジア人ではそれぞれ10.6ヵ月、13.3ヵ月 (HR=1.16, 95% CI: 0.59-2.28)、非アジア人ではそれぞれ9.8ヵ月、11.0ヵ月 (HR=1.07, 95% CI: 0.51-2.26) であり、いずれもOnartuzumabによる延長は認められなかった。
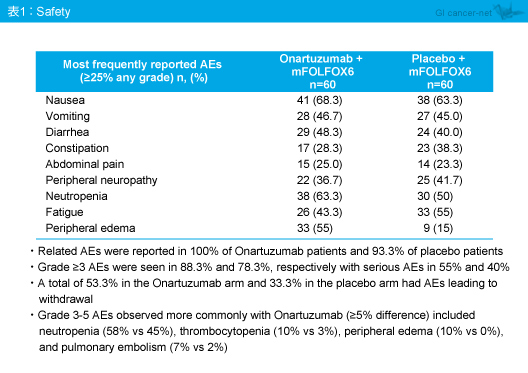
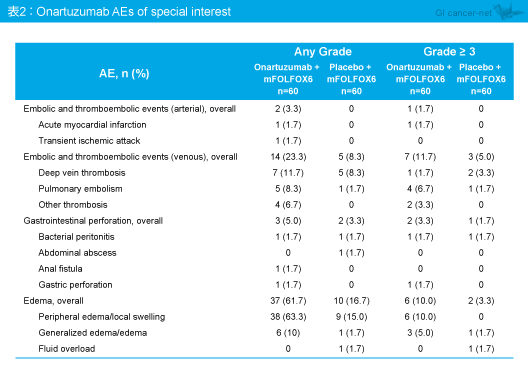
有害事象は両群で差はみられなかった (表1、2)。Grade 3以上の有害事象はmFOLFOX6 + Onartuzumab群88.3%、mFOLFOX6 + プラセボ群78.3%に認められ、mFOLFOX6 + Onartuzumab群で頻度が高かった有害事象 (5%以上の差) は、好中球減少 (58% vs. 45%)、血小板減少 (10% vs. 3%)、末梢浮腫 (10% vs. 0%)、肺塞栓症 (7% vs. 2%) であった。なお、有害事象による治療中止はmFOLFOX6 + Onartuzumab群53.3%、mFOLFOX6 + プラセボ群33.3%であり、治療関連死はそれぞれ6.5%、3.3%で認められた。
結論
本試験において、転移を有する胃食道腺癌に対する1st-lineとしてのmFOLFOX6へのOnartuzumabの併用は、MET陽性患者に限定しても主要評価項目であるPFSを改善しなかった。なお、Onartuzumabの安全性プロファイルは、これまでの試験結果と同様であった。
Reference
1) Bray F, et al.: Int J Cancer. 132(5): 1133-1145, 2013[
PubMed]
2) Gavine PR, et al.: Mol Oncol. 9(1): 323-333, 2015[
PubMed]
3) Toiyama Y, et al.: Int J Cancer. 130(12): 2912-2921, 2012[
PubMed]
4) Moss RA, et al.: ESMO 2010: abst #504P
5) Catenacci DV, et al.: Cancer Discov. 1(7): 573-579, 2011[
PubMed]