Abstract #1
経口METキナーゼ阻害剤AMG337の臨床活性:MET 増幅胃食道接合部癌・胃癌・食道癌成人患者における検討
Clinical Activity of AMG 337, A Highly Selective Oral MET Kinase Inhibitor, in Adult Patients with MET-amplified Gastroesophageal Junction, Gastric, or Esophageal Cancer
Eunice L Kwak, et al.
胃癌における希少フラクション治療の道標となるか
c-Met (hepatocyte growth factor receptor) 遺伝子 (
MET gene) は、胃癌における代表的な癌遺伝子であり、その遺伝子にコードされたタンパク質であるMETは、HGF (hepatocyte growth factor) をリガンドとするチロシンキナーゼ型レセプターである。HGF/MET pathwayは胃癌の増殖等に深く関与することは以前より知られており、また、METタンパクの過剰発現は多くの悪性腫瘍で予後不良因子と考えられ、胃癌においても悪性度に関与することが報告されている
1)。このHGF/MET阻害作用による胃癌治療開発に関しては、今まで、チロシンキナーゼ阻害薬 (TKI) であるARQ197
2)やMet抗体薬であるRilotumumab (AMG102)、Onartuzumab (MetMab) などが報告され、いずれも芳しい結果が得られていないのが現状である。2014年11月のRilotumumabを用いたRILOMET-1,2試験中止のプレスリリースは記憶に新しいが、本会においてもOnartuzumabを用いた無作為化第II相試験のnegativeな結果が報告されている (abstract #2)。
そのような状況のなかで、AMG 337はMETへの高い選択性を有するTKIであり、2014年米国臨床腫瘍学会年次集会において、胃癌に対する効果の可能性が初めて報告された
3)。今回はその追加報告である。FISHやNGS (次世代シーケンサー) で
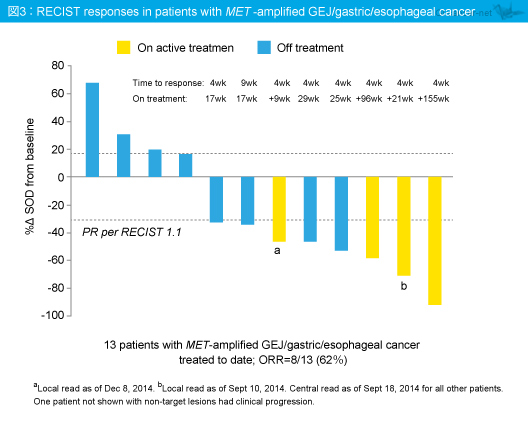
MET 増幅 (amplification) が認められた胃癌における8/13 (62%) の高い奏効率は、少ない症例数とはいえ今後の開発が大いに期待される。留意すべき毒性も頭痛と倦怠感くらいであり、将来的には併用療法の可能性もあるだろう。唯一の懸念は
MET 増幅が胃癌の5%程度と、症例がかなり限られることであろうが、これは近年の肺癌 (
ALK,
RET,
ROS1 融合遺伝子など) 治療も同様である。本剤により胃癌における希少フラクション治療が現実的なものとなる可能性を秘めている。
背景と目的
MET経路の調節異常は腫瘍増殖や転移を促進することが知られている。AMG 337は高い選択性を有する低分子経口METキナーゼ阻害剤で、細胞生存スクリーニングではMET 増幅の胃癌系列細胞のみが感受性を示した。本研究では、進行固形癌に対するAMG 337単剤療法の多施設共同オープンラベルの第I相試験を行い、MET 増幅胃食道接合部癌・胃癌・食道癌成人患者における臨床活性、安全性、忍容性について検討した。
対象と方法
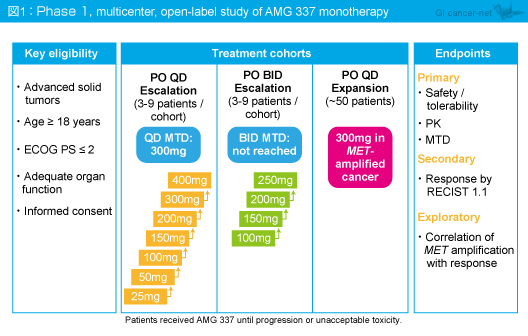
対象は、18歳以上でECOG PS 2以下、臓器機能が保持された評価可能病変を有する進行固形癌患者であった。AMG 337は1日1回もしくは1日2回投与とし、開始用量は1日1回投与では25mg 、1日2回投与では100mgから漸増し、病勢進行もしくは不忍容な有害事象を認めるまで投与した
(図1)。なお、
MET の過剰発現/増幅/変異を有する患者は、AMG 337を300mg、1日1回投与する拡大コホートに登録できるものとした。
主要評価項目は安全性/忍容性、薬物動態 (PK)、最大耐用量 (MTD) であり、副次評価項目は抗腫瘍効果 (RECIST ver1.1)、探索的評価項目は
MET 増幅と抗腫瘍効果との相関であった。
結果
登録症例90例の年齢中央値は59歳 (範囲: 19-85)、男性61.1%、ECOG PS 1以下が95.6%を占め、MET 増幅は19例 (21.1%) であった。なお、胃食道接合部癌・胃癌・食道癌患者は21例 (23.3%) であった。
1日1回投与コホートのMTDは300mg、1日2回投与コホートのMTDは未到達であった (図1)。
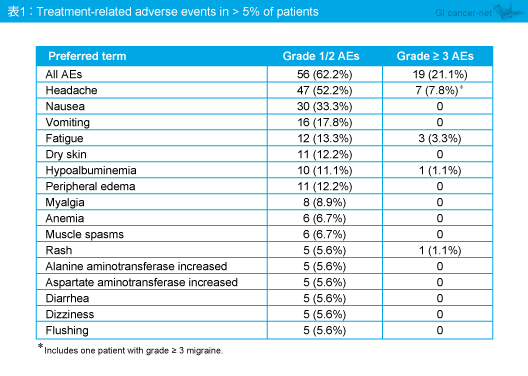
治療関連有害事象はgrade 1/2が62.2%、grade 3以上が21.1%に認められ、頭痛 (grade 1/2: 52.2%、grade 3以上: 7.8%)、悪心 (33.3%、0%)、嘔吐 (17.8%、0%)、倦怠感 (13.3%、3.3%)、皮膚乾燥 (12.2%、0%)、低アルブミン血症 (11.1%、1.1%)、末梢浮腫 (12.2%、0%) などが多くみられた (表)。なお、消化器癌の患者における有害事象の発現は、他癌種の患者と同様であった。
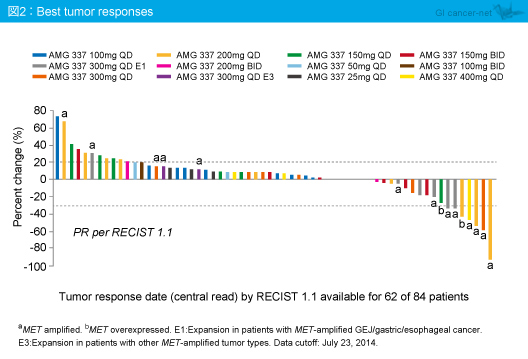
中央評価にて抗腫瘍効果の評価を行った62例では、MET 増幅例、およびMET過剰発現例において腫瘍縮小を認める傾向があり (図2)、MET 増幅胃食道接合部癌・胃癌・食道癌患者では13例中8例が奏効した (奏効率62%) (図3)。
結論
AMG 337単剤療法は、MET 高発現胃食道接合部癌・胃癌・食道癌において高い奏効率を認めた。主な治療関連有害事象は頭痛、悪心、嘔吐、倦怠感などであり、MTDおよび第II相試験推奨用量は300mg、1日1回投与であった。現在、MET 増幅例を対象としたMTD拡大コホート (50例まで) 研究、そしてMET 増幅胃食道接合部癌・胃癌・食道癌およびMET 増幅その他固形癌に対するAMG 337の第II相試験の登録が行われている4)。