ESMO 2014 Congress
胃 癌
Abstract #LBA15
進行胃癌に対するPembrolizumabの第Ib相試験
A Phase 1b Study of Pembrolizumab (Pembro; MK-3475) in Patients with Advanced Gastric Cancer
Kei Muro, et al.

Expert's view

市川 度 先生
昭和大学藤が丘病院
腫瘍内科
今回、室先生が胃癌に対するPembrolizumabのKEYNOTE-012 (第Ib相) 試験の結果を発表した。PD-L1発現が抗PD-1抗体の効果予測因子になるか否かは必ずしも一致していないが、本試験では悪性黒色腫に対するKEYNOTE-001試験1) の結果を参考に、PD-L1蛋白発現陽性例を対象としている。この背景としては、TCGA (The Cancer Genome Atlas) で胃癌が4つのサブタイプに分類され、EBVサブタイプではPD-L1/L2過剰発現が認められることも挙げられる2)。図2、図4から、本剤が極めて有望であることがうかがえ、奏効率が約30%であったことは、RamucirumabのREGARD試験と対照的である。悪性黒色腫よりも投与量は多い設定であるが忍容性も良好と考えられ、今後の臨床開発が期待される。ESMO2014の多くの発表のなかで、この演題に私は最も感動した。
PD-1は活性化T細胞表面に発現している抑制性の共刺激受容体で、リガンド (PD-L1、PD-L2) と結合することでエフェクターT細胞の機能を阻害する3)。また、腫瘍細胞やマクロファージ表面のPD-L1発現は、免疫監視を抑制し腫瘍の増殖が促進される4)。一方、胃癌ではPD-L1とPD-L2の発現の亢進が報告されている。
Pembrolizumabは、PD-L1とPD-L2を二重に遮断するヒト型IgG4抗PD-1抗体薬であり、様々な癌腫に対して臨床的な活性を示している。近年、IpilimumabやBRAF阻害剤使用後に増悪した切除不能メラノーマに対する治療として、米国で承認された。
KEYNOTE-012試験は、PD-L1陽性固形癌に対するPembrolizumabの第Ib相コホート試験であり、今回は胃癌における解析を行った。
Pembrolizumabは、PD-L1とPD-L2を二重に遮断するヒト型IgG4抗PD-1抗体薬であり、様々な癌腫に対して臨床的な活性を示している。近年、IpilimumabやBRAF阻害剤使用後に増悪した切除不能メラノーマに対する治療として、米国で承認された。
KEYNOTE-012試験は、PD-L1陽性固形癌に対するPembrolizumabの第Ib相コホート試験であり、今回は胃癌における解析を行った。
対象はECOG PS 0/1で、PD-L1陽性の再発または転移を有する胃・胃食道接合部腺癌患者であり、Pembrolizumab (10mg/kg, 2週毎) を静脈内投与して8週毎にRECIST ver. 1.1による効果判定を行った (図1)。PD-L1発現を評価した162例中65例 (40%) がPD-L1陽性であった。
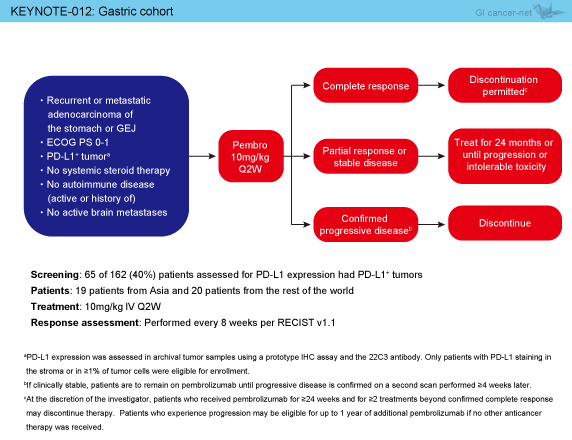
図1

アジア人19例、非アジア人20例の計39例が登録された。アジア人では男性 (84.2%)、胃切除歴のある症例 (57.9%)、進行病変に対する前治療が2回以上の症例 (78.9%) が、非アジア人に比べて多かった。
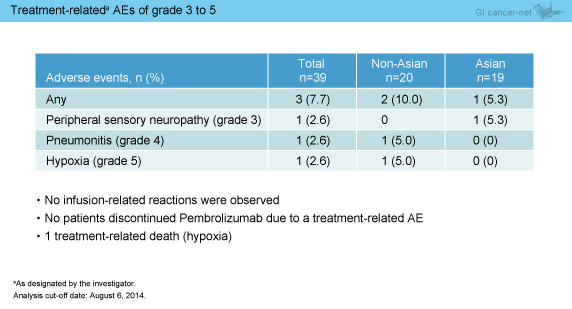
治療関連有害事象は24例 (61.5%) に認められ (表1)、grade 3-5は3例 (アジア人1例、非アジア人2例) であった (表2)。なお、infusion reactionは認めず、治療関連有害事象による治療中止例はなかったが、治療関連死が1例 (低酸素症) みられた。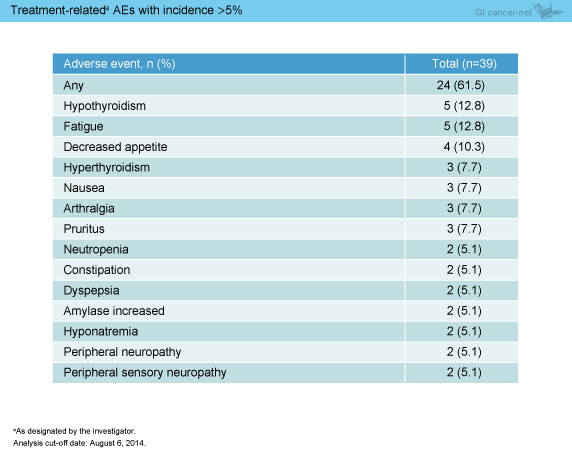
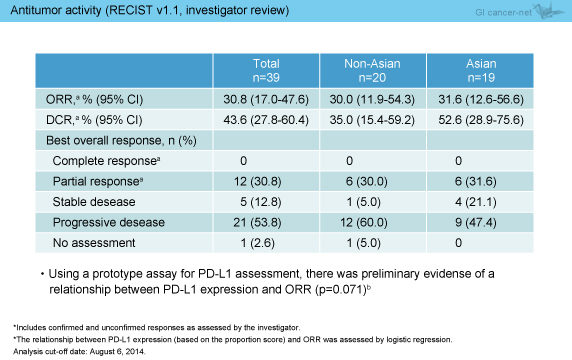
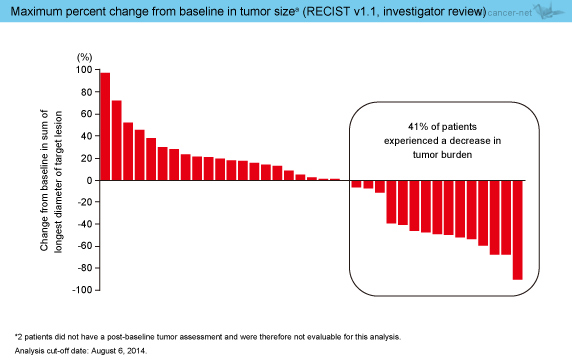
 担当医判定による抗腫瘍効果は、CR例は認めなかったものの、PRが12例 (アジア人6例、非アジア人6例)、SDが5例 (4例、1例) で得られ、奏効率は30.8%、病勢コントロール率は43.6%であった (表3)。また、腫瘍径のベースラインからの最大変化率におけるwaterfall plotは図2のとおりであり、41%で標的病変の縮小を認めた。
担当医判定による抗腫瘍効果は、CR例は認めなかったものの、PRが12例 (アジア人6例、非アジア人6例)、SDが5例 (4例、1例) で得られ、奏効率は30.8%、病勢コントロール率は43.6%であった (表3)。また、腫瘍径のベースラインからの最大変化率におけるwaterfall plotは図2のとおりであり、41%で標的病変の縮小を認めた。
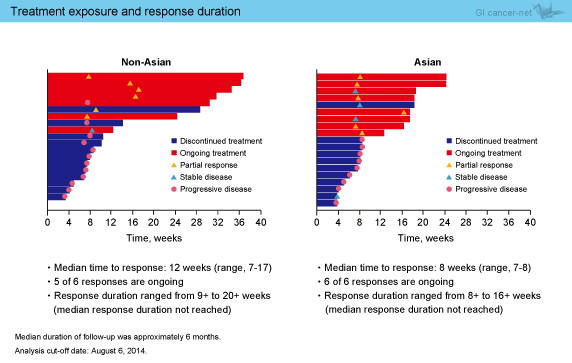
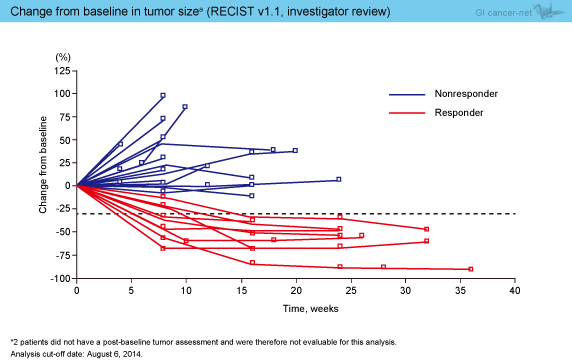
 奏効までの期間中央値は、アジア人8週、非アジア人12週であり、奏効期間はそれぞれ8〜16週 (中央値未到達)、9〜20週 (中央値未到達) であった (図3)。なお、腫瘍サイズのベースラインからの経時的変化の検討では、奏効は長期にわたることが認められた (図4)。
奏効までの期間中央値は、アジア人8週、非アジア人12週であり、奏効期間はそれぞれ8〜16週 (中央値未到達)、9〜20週 (中央値未到達) であった (図3)。なお、腫瘍サイズのベースラインからの経時的変化の検討では、奏効は長期にわたることが認められた (図4)。
治療関連有害事象は24例 (61.5%) に認められ (表1)、grade 3-5は3例 (アジア人1例、非アジア人2例) であった (表2)。なお、infusion reactionは認めず、治療関連有害事象による治療中止例はなかったが、治療関連死が1例 (低酸素症) みられた。
表1

表2

表3

図2

図3

図4

PD-L1陽性胃癌患者におけるPembrolizumabの安全性および忍容性プロファイルは許容されるものであり、アジア人、非アジア人ともに持続的な抗腫瘍効果が得られた。これらの知見はさらなる検討を支持するものであり、第II相試験の患者登録の準備が進められている。
1) Kefford R, et al.: 2014 Annual Meeting of the American Society of Clinical Oncology®: abstr #3005
2) Cancer Genome Atlas Research Network.: Nature. 513(7517): 202-209, 2014 [PubMed]
3) Keir ME, et al.: Annu Rev Immunol. 26: 677-704, 2008 [PubMed]
4) Pardoll DM.: Nat Rev Cancer. 12(12): 252-264, 2012 [PubMed]
2) Cancer Genome Atlas Research Network.: Nature. 513(7517): 202-209, 2014 [PubMed]
3) Keir ME, et al.: Annu Rev Immunol. 26: 677-704, 2008 [PubMed]
4) Pardoll DM.: Nat Rev Cancer. 12(12): 252-264, 2012 [PubMed]
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。

