The European Cancer Congress 2013 - ESMO


本邦で開発された新規抗癌剤のTAS-102はTS阻害のほかにDNAに取り込まれることによるDNA機能障害作用を有するため、フッ化ピリミジン系製剤に抵抗性となった症例に対しても抗腫瘍効果が期待できる。実際、本邦で行われたフッ化ピリミジン系製剤、CPT-11、L-OHPに不応・不耐となった切除不能進行・再発大腸癌を対象としたプラセボ対照の第II相試験においてOS (overall survival) を有意に延長した (HR=0.56, p=0.0011) 1)。
今回報告されたEPOC1201試験では胃癌における有効性、安全性が検討され、安全性に関してはgrade 3以上の好中球減少を主体とした血液毒性が高頻度に認められたが、grade 3以上の非血液毒性の頻度はそれほど高くはなく、大腸癌におけるプロファイルと同様であり忍容可能と考えられた。また、有効性に関しては3rd-lineを対象とした本試験において、2nd-lineを対象にPaclitaxelとCPT-11を比較した第III相試験 (WJOG4007試験) におけるPFS中央値 (それぞれ3.6ヵ月、2.3ヵ月)、OS中央値 (それぞれ9.5ヵ月、8.4ヵ月) と同程度の成績を示していることより、単アームの第II相試験ということを勘案しても十分有望といえるだろう。
現在、大腸癌領域では第II相試験の結果を受けて、日米欧で800例規模の第III相試験が進行中であり、今後、胃癌領域においても検証試験が速やかに実施されることを期待する。
TAS-102は、トリフルオロチミジン (FTD) と、その分解を阻害するチミジンホスホリラーゼ (TP) の阻害薬であるチピラシル塩酸塩 (TPI) を1対0.5の比率で配合した新規の経口ヌクレオシド系抗悪性腫瘍薬である 2)。米国で行われた進行胃癌に対する第II相試験 (25mg/m2 1日2回投与) では十分な効果が得られなかったが、日本での第I相試験では35mg/m2 1日2回投与が推奨されており 3)、同用量で行われた切除不能進行・再発大腸癌の第II相試験では有望なベネフィットが示されている 1)。
そこで、大腸癌と同一の用量および投与スケジュールにおいて、進行胃癌に対するTAS-102の安全性と有効性を評価するため、多施設共同第II相試験を行った。
対象は20歳以上、ECOG PS 0-2で、フッ化ピリミジン系製剤、プラチナ製剤、タキサン製剤、CPT-11による1~2レジメンの治療歴を有する進行胃癌患者であった。
TAS-102 (35mg/m2 1日2回経口投与) の投与スケジュールは、5投2休で2週投与2週休薬する28日間を1サイクルとし、増悪または許容されない毒性が発現するまで繰り返し投与した。また、奏効の評価にはRECIST v1.1を用い、8週目までは4週毎、その後は4~6週毎に評価した。
主要評価項目は担当医評価による8週時の病勢コントロール率 (DCR) とし、per-protocol解析を行った。また、副次評価項目は奏効率、PFS (progression-free survival)、OS (overall survival)、安全性プロファイル、PKパラメーターであった。
Simonのtwo-stage minimal designを用いて、DCR≦30%の帰無仮説と≧50%の対立仮説を検出力80%、片側α=0.1で検討した。なお、12例中4例以上の病勢コントロールが得られた場合 (1st stage)、16例が登録されるものとした (2nd stage)。
29例が登録され、患者背景は、年齢中央値64.0歳、男性19例、ECOG PS 0が20例であった。18例が胃切除術を受けており、前治療は全例が2レジメンで、治療中止理由は26例がPD、2例が有害事象であった。また、前治療で使用された薬剤は、フッ化ピリミジン系製剤およびプラチナ製剤が全例、タキサン製剤が18例、CPT-11が11例であった。
8週時の相対用量強度 (relative dose intensity: RDI) 中央値は100%、全期間のRDI中央値も100%であり、サイクル数の中央値は3サイクルであった。
腫瘍縮小は12例 (41.4%) で認められ (図1)、PR 1例、SD 18例であり、DCRは65.5% (95% CI: 45.7-82.1)、奏効率は3.5% (95% CI: 0.09-17.8) であった。
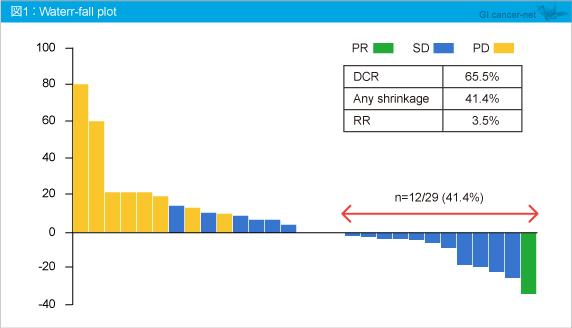
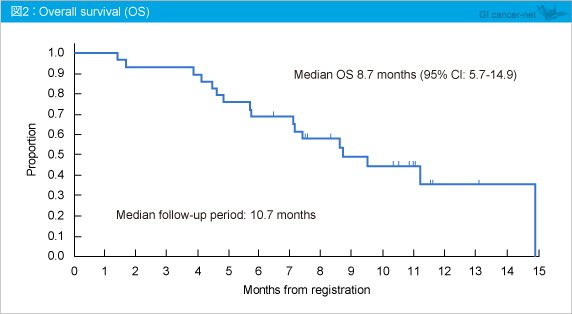
また、PFS中央値は2.9ヵ月 (95% CI: 1.1-4.4) であり、追跡期間中央値10.7ヵ月におけるOS中央値は8.7ヵ月 (95% CI: 5.7-14.9) (図2) であった。
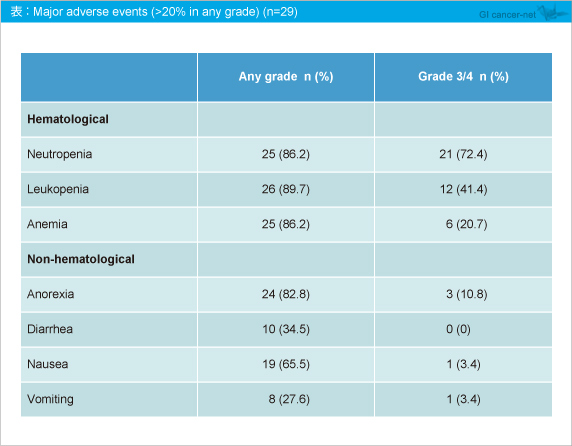
Grade 3/4の有害事象は、好中球減少が21例 (72.4%)、白血球減少が12例 (41.4%)、貧血が6例 (20.7%)、食欲不振が3例 (10.8%) に認められた (表)。なお、発熱性好中球減少は1例に認められ、治療関連死はみられなかった。
FTD、FTY (FTDの不活性体)、TPIのPKパラメーターの推移は日本の第I相試験 3) と類似しており、胃切除術の有無による差異は認められなかった。
既治療の進行胃癌患者に対して大腸癌と同一の用量および投与スケジュールを用いたTAS-102単剤療法は、DCR 65.5%という臨床的に有望な抗腫瘍活性を示し、安全性プロファイルは十分に許容できるものであった。TAS-102は高い有効性を発揮する可能性があり、今後、検証試験を行う必要がある。


