The European Cancer Congress 2013 - ESMO

VELOUR試験は切除不能進行・再発大腸癌患者を対象として、FOLFIRI + placeboに対するFOLFIRI + Afliberceptの優越性を検証した試験であり、既に主要評価項目であるOS (overall survival) において優越性が報告されている (HR=0.817, p=0.0032) 1)。
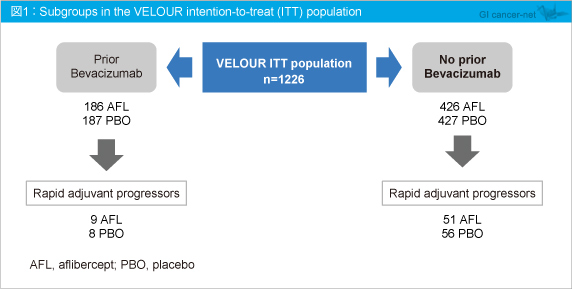
本会ではプロトコールで予定されていない探索的解析として、L-OHPベースの術後補助化学療法後、6ヵ月以内に再発した症例を除外して解析された有効性データが報告された。Bevacizumab (Bev) を含む前治療症例 (Aflibercept群186例、placebo群187例) では17例[各9例 (4.8%)、8例 (4.3%) ]、Bevを含まない前治療症例 (各426例、427例) では107例[51例 (12.0%)、56例 (13.1%) ]が該当し、本解析から除外された。これらの症例を除外した結果、ITT集団におけるOSおよびPFS (progression-free survival)、前治療毎に層別化したOSにおいて、除外前の全対象の解析よりも良好なHRになることが示された。
今回の解析の真意はどこにあるのだろうか?術後補助化学療法終了後6ヵ月以内の再発例はしばしば経験され、そのような症例はその次の治療がいわゆる2nd-lineに該当する。2nd-line以降の試験ではこのような早期術後再発例を含むことが一般的であり、他の試験ではこれらの症例を除外した報告が少ない現状では、他のレジメンおよび試験との比較は困難である。また、少数例の早期術後再発例を除外することでHRが改善するということは、逆に早期術後再発例においてAfliberceptの有効性があるのかどうかが非常に気にかかる結果であり、今後の報告を切望する。
VELOUR試験に本邦は参加しておらず、現在、承認申請へ向けてのAfliberceptの開発治験が進行中であるが、承認された後、BBP (Bev beyond progression) との使い分けや、今回報告された早期術後再発例などに対する有効性など、種々の検討が必要である。
AfliberceptはBevよりもVEGF-Aに高い親和性で結合し、PlGFやVEGF-Bにも結合する。
1st-lineでL-OHPベースの治療を受けた切除不能進行・再発大腸癌の2nd-lineにおいて、FOLFIRIに対するAfliberceptの上乗せ効果を検討した第III相試験、VEROUR試験の結果、FOLFIRI + Aflibercept (Aflibercept群) はFOLFIRI + placebo (placebo群) に対しOS の有意な改善を認めた (HR=0.817, 95.34% CI: 0.713-0.937, p=0.0032) 1)。
事前に設定されたサブ解析において、Bev治療歴により層別化された結果、Bev治療歴のある症例は約30%であり、治療群全体とBev治療歴との間に有意な相関は認めらなかった。
一般的に、術後補助化学療法後に早期再発した症例 (L-OHPベースの術後補助化学療法後6ヵ月未満に再発した症例) は切除不能進行・再発大腸癌の第III相試験から除外される。VELOUR試験のように早期術後再発例を含めた試験では、これらの症例が治療抵抗性を示し、極端に予後不良であることが全体の試験結果に影響を及ぼしている。また、2nd-lineにおけるBevの継続使用を検討したML18147試験では早期術後再発例を含んでいなかった。
そこで、VELOUR試験のITT集団から早期術後再発例を除き、Bev治療歴による解析を含めた有効性が検討された。
VELOUR試験のITT集団1,226例のうちAflibercept群186例、placebo群187例にBevによる治療歴があり、同様にそれぞれ426例、427例は治療歴がなかった。Bev治療歴がある症例における早期術後再発例はAflibercept群9例、placebo群8例であり、治療歴がない症例ではそれぞれ51例、56例であった (図1)。
ベースラインの患者背景および有効性は、早期術後再発例を除いたITT集団においてBevによる治療歴により検討された。なお、OSおよびPFS解析はKaplan-Meier法により中央値を推定され、ハザード比はCox比例ハザードモデルにより求められた。
早期術後再発例を除いたITT集団におけるOS中央値は、Aflibercept群 (n=552) 13.80ヵ月、placebo群 (n=550) 11.93ヵ月と、Aflibercept群で1.87ヵ月の延長がみられ (HR=0.779, 95% CI: 0.677-0.897)、全ITT集団における1.4ヵ月差より広がった。
同様にPFS中央値はAflibercept群6.80ヵ月、placebo群4.53ヵ月と、Aflibercept群で2.27ヵ月の延長がみられ (HR=0.735, 95% CI: 0.638-0.848)、全ITT集団における2.2ヵ月差より広がった。
Bev治療歴による解析では、全ITT集団でBev治療歴がある症例におけるOS中央値はAflibercept群12.5ヵ月、placebo群11.7ヵ月であり、0.8ヵ月の差であった。一方、Bev治療歴がない症例から早期術後再発例を除いた集団では、OS中央値はAflibercept群13.73ヵ月、placebo群12.42ヵ月であった (HR=0.766, 95% CI: 0.645-0.908)。また、Bev治療歴がある症例から早期術後再発例を除いた集団では、それぞれ13.80ヵ月、11.66ヵ月と約2.1ヵ月の差がみられた (HR=0.812, 95% CI: 0.634-1.042) (図2)。
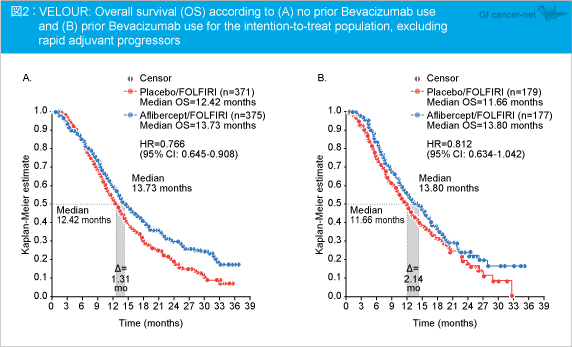
なお、早期術後再発例を除いた集団におけるPFS中央値は、Bev治療歴がない症例ではAflibercept群6.9ヵ月、placebo群5.3ヵ月であり (HR=0.777, 95% CI: 0.655-0.921)、Bev治療歴がある症例ではそれぞれ6.7ヵ月、3.9ヵ月であった (HR=0.645, 95% CI: 0.498-0.835)。
VELOUR試験のITT集団から早期術後再発例を除いた結果、OS中央値におけるAflibercept群とplacebo群の差は約1.9ヵ月となり、HRも0.779となった。また、早期術後再発例を除くことで、Bev治療歴の有無にかかわらずOSの改善がみられた。
この結果から、早期再発など腫瘍特性の違いを考慮することの重要性が増したと考えられる。現在、Afliberceptのベネフィットを得られる患者を絞り込むことができる予後因子、効果予測因子を特定するため、VELOUR試験を含む腫瘍標本を集積しているところである。


