The European Cancer Congress 2013 - ESMO

�@�REGFR�R�̖�̓o��ȗ��A���E���Ŏ��Ì��ʗ\�����q�̒T�����s���Ă����B������IHC�ɂ��EGFR������L����ǗႪ�REGFR�R�̖�̓K���Ƃ���Ă������A��K�͗Տ������̌��͂ɂ��EGFR�����̒��x�ƍREGFR�R�̖�̌��ʂɂ͑��ւ��Ȃ����Ƃ������ꂽ�B���̌�AKRAS exon 2 (codon 12, 13) �ψق�L����Ǘ�ɂ͍REGFR�R�̖����ł��邱�Ƃ������̗Տ������̌��͂̌��ʂ�莦����A�REGFR�R�̖�̓K����KRAS ��`�q�쐶�^�Ɍ��肳���悤�ɂȂ����B����ɍ��N�̕č��Տ���ᇊw��AECC/ESMO�ł�KRAS exon 2�����ł͂Ȃ��A���̃}�C�i�[��RAS ��`�q�ψق�L����Ǘ�ɂ����Ă��REGFR�R�̖�̌��ʂ����҂ł��Ȃ����Ƃ�����A����A�REGFR�R�̖�̓K����KRAS �쐶�^����RAS �쐶�^�ւ���ɍi�荞�܂�Ă������낤�B
�@�����2�̎����͍REGFR�R�̖�̏����ϐ� (���ʗ\��) �Ɋւ���`�q��T���I�Ɍ��������B#2186�ł͍זE����p���������ŗL�]�Ȍ��ʂ������Ă��邪�A����͗Տ����̂�p����������heterogeneity���������Č����������邩�A#2399�ł͗Տ������̃T���v����p���ĕ����̈�`�q�����̑g�ݍ��킹�����ʗ\�������݂Ă���A�����̈�`�q�ψفE�������֗^���Ă���咰���ɂ����Ă͋����[���A�v���[�`�Ƃ����邪�A������̌����ł��邱�Ƃ���K�͗Տ������̃T���v����p���������d�v�ł���B
�@��������̂悤�ȒT���I���������ƂɌ����d�ˁAbeyond KRAS ����beyond RAS �̎�����}���邱�Ƃ����҂������B
�@��琬�����q��e�� (epidermal growth factor receptor: EGFR) �́A�זE���B�A�Z���A���ǐV���A�]�ځA�A�|�g�[�V�X�}���Ȃǂɂ����זE�̐����𑣐i�����邱�Ƃɂ��A���m�N���[�i���R�̖�ɂ�鎡�ÕW�I�ƂȂ��Ă���B�������A�REGFR�R�̖�ɂ�鎡�Â����؏��s�\�i�s�E�Ĕ��咰�����҂̑����͎��Ò�R���������悤�ɂȂ�B�܂��AKRAS ��BRAF �ψق̂悤�ȃo�C�I�}�[�J�[�͍REGFR�R�̖�̎��Ò�R���̗\�����q�ƂȂ邱�Ƃ�����Ă���B�����ŁA�咰���זE����p���āA�REGFR�Ö@��R���̃o�C�I�}�[�J�[�ɂ��Č��������B
�@KRAS /BRAF �쐶�^�̑咰���זE���̍REGFR�R�̖�ɑ��銴����ђ�R���̑���ɂ�CellTiter 96® AQueous Proliferation Assay��p���A�זE���B����50%�ȏ�ł���Β�R���A50%�����ł���Ί��Ɣ��肵���B����/��R���̍��ق������炷�o�C�I�}�[�J�[�̔�����RT-Profiler Array��p���Č��肵�AqRT-PCR�@�ŕ]�������B�܂��A��R���זE���ɂ����ĉߏ蔭�������o�C�I�}�[�J�[��siRNA��p���ăm�b�N�_�E�����A�ēxqRT-PCR�@�ŕ]�������B�����āAsiRNA�ɂ��m�b�N�_�E����̍זE���ɂ�����REGFR�Ö@�ւ̒�R���̕ω������������B
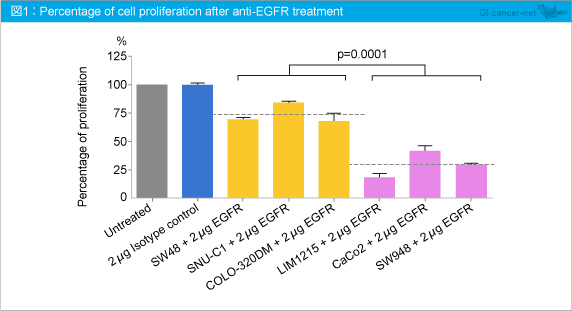
�@�e��זE����72���Ԕ|�{�����Ƃ���ASW48 (70%)�ASNU-C1 (83.8%)�ACOLO-320DM (68.3%) �̍זE���͍REGFR�Ö@�ɒ�R���ł���ALIM1215 (18.6%)�ACaCo2 (42%)�ASW948 (29.1%) �͊��������� (�}1)�B
�@��R�����������זE���ɉߏ蔭�����Ă����`�q�́ASW48: EGR1 �ASNU-C1: HBEGF �ACOLO-320DM: AKT3 �ł���A�����̈�`�q�ɑ���siRNA�Ö@��72���ԑ������Ƃ���A���ꂼ��85.6%�A79.4%�A95.3%���m�b�N�_�E�����ꂽ�B
�@���̌�A�e�זE���ɍREGFR�Ö@��24���ԍs�����Ƃ���AEGR1 �m�b�N�_�E���זE�̑��B����49.1%�ł���A�m�b�N�_�E������Ă��Ȃ��זE��99.8%�Ɣ�ׂĒႩ�����B���l�ɁAHBEGF �͂��ꂼ��46.9%�A103.2%�AAKT3 �͂��ꂼ��64.1%�A92.2%�ł���A�e��`�q�m�b�N�_�E���זE�͍REGFR�Ö@�ɑ��Ċ��������悤�ɂȂ����B
�@����̌����ł́AEGR1 �AHBEGF �AAKT3 ���זE���B�V�O�i�������Ɋ֗^���Ă��邱�Ƃ������ꂽ (�}2)�B
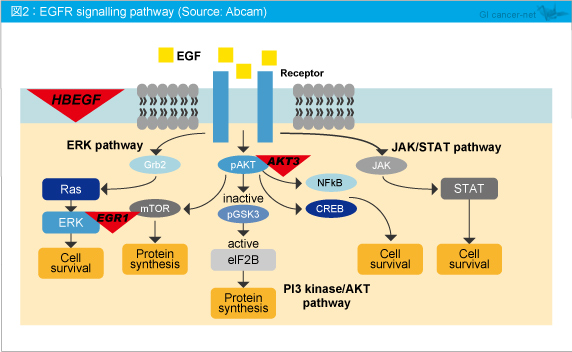
�@HBEGF �̓G�N�g�h���C���V�F�f�B���O�ɂ��n�^HBEGF �Ƃ��čזE�O�ɕ��o����AEGFR�n����ERK/MAPK�����ɂ����זE�̑������B
�@EGR1 ��ERK�����Ɋւ��]�ʈ��q�ł���AERK�̃����_���ɂ��זE�j�ւ̈ڍs�ɂ��A�זE���B�𑣐i������B
�@AKT ������GSK3������j�Q����BGSK3�͐^�j�����|��J�n���q2B�����������邪�A���̈��q�͖|��J�n���Ƀ��{�\�[����U�����A�^���p�N���������B
�@�����̉ߏ蔭�������o�C�I�}�[�J�[����͂��邱�ƂŁA�REGFR�Ö@�̒�R������ʂ�\��������q�����o����\��������B

�@�咰���ɂ͏��Ȃ��Ƃ�6�̐����w�I�T�u�^�C�v�������������Ƃɂ��A��ʉ����ꂽ���w�Ö@�ł͂Ȃ������w�I�ȓ����ɑ��������Â̕K�v���������Ă���B
�@Panitumumab�͒P�ܓ��^��KRAS �쐶�^�̐؏��s�\�i�s�E�Ĕ��咰�����҂�PFS�����P���邱�Ƃ�������Ă��邪�A�S�Ă̏Ǘ�ł��̃x�l�t�B�b�g��������킯�ł͂Ȃ��B����̑�II�������̖ړI�́A�؏��s�\�i�s�E�Ĕ��咰���ɑ���3rd-line�Ƃ��Ă�Panitumumab�P�Ɠ��^�Ǘ�ɂ�������ʗ\����`�q��T���I�Ɍ������邱�Ƃł���A�ߋ��ɕ��ꂽCetuximab�̌��ʗ\���A�����BRAF �ψقɗގ������\���^�̌���`�q�̔����ɂ��Č��������B
�@�Ώۂ�KRAS (codon 12, 13) �쐶�^�̐؏��s�\�i�s�E�Ĕ��咰��3rd-line��ł���APanitumumab�P�� (6mg/kg, 2�T��) ������܂œ��^�����B�Ȃ��A���ʔ����2������1�xCT�ɂĕ]������ (RECIST)�B
�@��`�q��͂ɂ��ẮA�g�D�W�{����RNA�𒊏o���A�����BRAF �ψفACetuximab�̌��ʗ\����`�q�����܂�121��ނ̈�`�q��NanoString nCounter®��p���đ��肵���B
�@�W�{��8�̃n�E�X�L�[�s���O��`�q (ACTB �AGUSB �APSMC4 �ARPLP0 �APUM1 �ASF3A1 �ATFRC �AMRPL19 ) �ɂ��W��������A�܂��ATCGA (The Cancer Genome Atlas) �ɓo�^���ꂽ��`�q�����f�[�^�x�[�X�ɕW�������ꂽ�B�����āASAM (significant analysis of microarrays) �\�t�g�E�G�A��p����Panitumumab�ϐ���`�q�̃����N�t�����s�����B
�@�o�^���ꂽ40��̂���37���RECIST�ł̕]�����\�ł���APR 8��ASD 17��APD 12��ł������B37�̌������W�{�����12�̓]�ڑ��W�{���W�ς���A������37�ᒆ35��A�]�ڑ�12�ᒆ7���IHC�@�ɂ��HER2 status�̃X�R�A�����\�ł������B
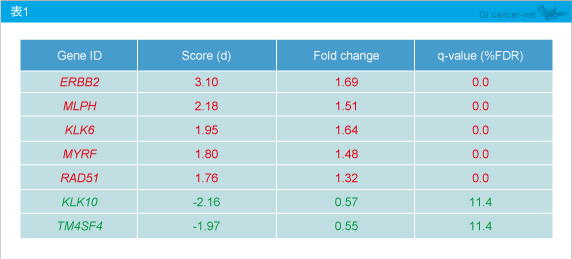
�@TCGA�R�z�[�g�ɂ�����100��`�q�Z�b�g�̊K�w�I�N���X�^�����O���͂�KRAS �ψقƂ̊Ԃɂ͗L�ӂȑ��ւ݂͂��Ȃ������B�܂��APanitumumab���^��PD�ł������Ǘ�ɂ����āATCGA�ւ̕W�����O�̃R�z�[�g��SAM��͂��s�����Ƃ���AERBB2 �ARAD51 �AMLPH �AKLK6 �AMYRF ���ߏ蔭�����Ă��� (�\1)�B
�@���t�Ȃ��@�ɂ��K�w�I�N���X�^�����O�ɂāATCGA�ɕW�������ꂽ�R�z�[�g��2�̎�v�ȃN���X�^�[�ɕ��ނ���邱�Ƃ������ꂽ�B�܂��A7�̓]�ڑ��W�{�͑Ή����錴�����W�{�̃N���X�^�[�ߖT�ɁA5�̓]�ڑ��W�{�͑Ή����錴�����W�{�Ɠ����N���X�^�[�ɑ��݂������Ƃ���A�R�z�[�g�̑����̌������Ɠ]�ڑ��͓��l�̈�`�q�����v���t�@�C���������Ƃ������ꂽ�B
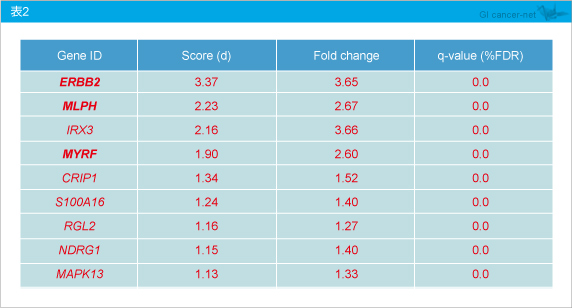
�@�܂��A�W�����O�Ɠ��l��SAM��͂��s�������ʁAPanitumumab��R���Ɋ֗^����9�̈�`�q�����肳�ꂽ (�\2)�B�Ȃ��A9�̂���3�̈�`�q (ERBB2 �AMLPH �AMYRF ) �͕W�����O�̌��ʂƏd�������B�X�R�A��ʂ�8�̈�`�q�Ƃ��ꂼ��̃X�R�A���v�Z�����Ƃ���A�e�X�R�A��Panitumumab�t���Ƃ̊Ԃɋ������ւ��F�߂�ꂽ (p=0.041)�B
�@HER2 status��IHC�X�R�A�����\�ł�����35�����͂������ʁAIHC�X�R�A[�ᔭ���Q (IHC�X�R�A 0-2) vs. �ߏ蔭���Q (3+) ] ��Panitumumab�ɂ��t���ɂ́A�L�ӂȕ��̑��ւ��F�߂�ꂽ (p=0.014)�B
�@KRAS �쐶�^�؏��s�\�i�s�E�Ĕ��咰���ɑ���3rd-line�ɂ�����Panitumumab�P�܂̑�II�������̌��ʁA�a���R���g���[������68%�ł������B
�@Panitumumab��R���Ɋւ���`�q������9���肳��A���̂���8��ނ�Panitumumab��R����L�ӂɗ\�����Ă���AERBB2 ���ł��ߏ蔭�����Ă����B�܂��AHER2��IHC�X�R�A��Panitumumab��R���ƗL�ӂȕ��̑��ւɂ��邱�Ƃ������ꂽ�B
�@���݁A���R�z�[�g�ɂ�����Sexome�V�[�N�G���V���O���i�s���ł���B


