
The 35th ESMO Congress, Milan 2010
Abstract #607P |
Phase II Trial of Combined Chemotherapy with Irinotecan, S-1, and Bevacizumab in Patients with Metastatic Colorectal Cancer
Y. Komatsu, et al.
|
IRIS + Bevacizumab療法は忍用性あり、1st-line治療に最適の可能性 |
|
|
今年は、FIRIS試験がLancet Oncologyに掲載され、大腸癌2nd-lineにおいて、世界標準療法であるFOLFIRIとIRISの非劣性が証明された。我々はこれに先駆け、IRISとBevacizumabの1st-lineにおける安全性の証明と有用性を期待し、本試験を計画、実施した。IRISは、報告の度に下痢などの有害事象が問題とされるため、本試験も安全性を一次エンドポイントとし、本来興味のある効果に関しては二次エンドポイントとして実施した。 |
我々は2007年 米国臨床腫瘍学会年次集会において、IRIS (S-1 + Irinotecan) が進行再発大腸癌における1st-line治療として有効性が高く (Response rate: 52.5%、progression-free survival: 8.6ヵ月)、忍容性に優れることを報告した1)。また、日本で実施された第III相試験 (FIRIS試験) により、2nd-line治療としてのIRISとFOLFIRIとの同等性が証明されている2)。
今回、進行再発大腸癌の標準治療薬であるBevacizumabとIRISの併用療法を検討した多施設共同シングルアーム第II相試験の最終結果を報告する。
対象は、組織学的に腺癌と確定診断された未治療の転移性大腸癌患者 (20歳以上、ECOG PS 0/1) とした。
- 治療スケジュール
28日を1サイクルとし、各薬剤を下記の通りに投与する。 |
||
| ・ | S-1: 80-120 mg, day 1-14, bid, p.o.(用量は体表面積により決定), day 15-28は休薬 |
|
| ・ | Irinotecan: 100 mg/m2, day 1および15, 90 min, iv投与 |
|
| ・ | Bevacizumab: 5 mg/kg, day 1および15, 90 min, iv投与 |
|
一次エンドポイントは安全性および毒性、二次エンドポイントはresponse rate (RR)、progression-free survival (PFS)、overall survival (OS)、治療完遂率とした。
2007年10月〜2009年3月に9施設から53例が登録された。1例が治療を拒否したため、52例を対象に解析を行った。
患者の年齢中央値は63.5歳、男性33例 (63.5%) であった。腫瘍部位は結腸35例 (67.3%)、直腸17例 (32.7%) であり、転移部位は肝臓35例 (67.3%)、肺23例 (44.2%)、リンパ節23例 (44.2%)、腹膜7例 (13.5%) であった。
Grade 3以上の主な有害事象は、下痢 (17%)、好中球減少 (27%)、貧血 (12%)、高血圧 (21%) であった。治療期間中央値は8ヵ月、相対用量強度はS-1およびCPT-11、Bevacizumabのいずれも90%以上であった。
二次エンドポイントであるRRは57.7% (詳細は下表)、PFS中央値は16.7ヵ月 (95%CI: 13.1-18.7) であり、OSは中央値に到達しなかった。
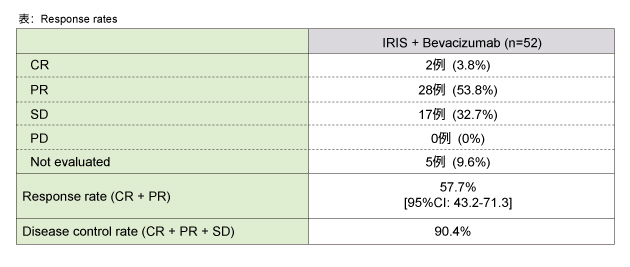
以上より、IRIS + Bevacizumab療法は忍容性に優れ、高い有効性を示すことが確認された。本治療法は進行再発大腸癌に対する1st-line治療の選択肢の1つになり得ると考えられ、現在、標準治療との比較試験を計画中である。

