
The 35th ESMO Congress, Milan 2010
Abstract #600P |
Multicenter Phase II study of second-line FOLFIRI + Cetuximab with KRAS wild type gene in metastatic CRC (FLIER)
T. Kato, et al.
|
FOLFIRI + CetuximabはKRAS遺伝子野生型患者の2nd-lineにおける選択肢の1つである |
|
|
FLIER試験は本邦初のKRAS遺伝子野生型の症例を対象とした、2nd-lineの多施設共同プロスペクティブ試験であり、1st-lineは5-FU + Oxaliplatinベース療法を施行した症例のみを対象とした。 |
Cetuximabは日本では2008年9月に承認されたが、KRAS遺伝子検査が健康保険の適用外であったため、KRAS statusをプロスペクティブに評価した国内臨床試験は行われていない。また、転移性大腸癌患者に対する2nd-lineとしてのFOLFIRI + Cetuximab療法のエビデンスは確立されていない。我々は、日本のKRAS遺伝子野生型の転移性大腸癌患者に対する2nd-lineとしてのFOLFIRI + Cetuximab療法の有用性を評価するため、多施設共同第II相試験を実施した。
対象はEGFR陽性かつKRAS遺伝子野生型であり、1st-lineとして5-FU + Oxaliplatinベースの化学療法が施行された患者とした (ECOG PS 0/1)。
Irinotecanの投与量は日本の承認用量である150 mg/m2とし、UGT1A1遺伝子多型*28、*6がホモ型またはともにヘテロ型の場合は100 mg/m2とした。FOLFIRIは2週毎、Cetuximabは毎週投与とした。
一次エンドポイントはresponse rate (RR)、二次エンドポイントはprogression-free survival (PFS)、disease control rate (DCR)、overall survival (OS)、安全性などとした。
2008年12月〜2009年12月までに112例が登録され、KRAS遺伝子野生型かつ適格基準に該当する60例に対し解析を行った。年齢中央値は62.6歳、男性39/60例、PSは0: 45例、1: 6例であった。
KRAS遺伝子変異率は40.2% (45/112例)であり、codon 12変異は37例、codon 13変異は8例であった。UGT1A1*28、*6のホモ型はそれぞれ2.8%、4.7%であった。
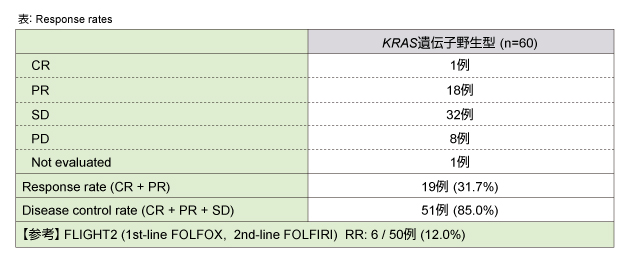
一次エンドポイントであるRRは31.7% (詳細は下表)、二次エンドポイントであるPFS中央値は9ヵ月 (95% CI: 164-391日) であり、OSは中央値に到達しなかった。
Grade 3/4の主な有害事象は白血球減少30%、好中球減少48%、嘔吐6%、皮膚の亀裂12%、爪囲炎10%であり、Grade 3/4の下痢は0%であった。
FLIER試験はKRAS遺伝子をプロスペクティブに解析し、転移性大腸癌患者における2nd-lineとしてのFOLFIRI + Cetuximab療法の有用性を検討した日本初の多施設共同第II相試験である。本試験結果より、FOLFIRI + Cetuximab療法は忍容性に優れ、有効性があることが確認された。日本では2010年4月にKRAS遺伝子検査が健康保険の適用となり、実臨床においてもKRAS statusに基づいた個別化治療が可能となっている。

